Ионно – молекулярные (ионные) реакции обмена
Для решения задач этого раздела рекомендуем воспользоваться литературой 4, 6, 8, 14 и таблицей 7.

Электролиты – вещества, которые в растворенном или расплавленном состоянии проводят электрический ток. При растворении в воде или других полярных растворителях электролиты подвергаются электролитической диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы.
Уравнения диссоциации обычно записываются следующим образом:
 ;
; 

Нужно иметь ввиду, что эти уравнения только приблизительно отображают подлинный процесс диссоциации, поскольку не показано участие молекул растворителя, без которого сама диссоциация невозможна.
Электролиты практически полностью диссоциирующие на ионы называются сильными электролитами. К ним относятся большинство неорганических солей, гидроксиды щелочных металлов, растворимые гидроксиды щелочноземельных металлов, некоторые минеральные кислоты, например, 
Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. К ним относятся почти все органические кислоты, некоторые минеральные кислоты, например,  , многие основания металлов, а также
, многие основания металлов, а также 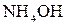 .
.
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации – ионами. В этом случае можно применить законы химического равновесия и записать выражение константы равновесия. Например, в водном растворе уксусной кислоты устанавливается равновесие:
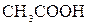 ⇄
⇄ 
которое характеризуется константой равновесия (константой диссоциации):
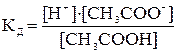 .
.
Величина 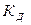 зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данного электролита распадаться на ионы: чем выше
зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данного электролита распадаться на ионы: чем выше  , тем легче электролит диссоциирует.
, тем легче электролит диссоциирует.
В табл. 4 приведены значения констант диссоциации некоторых слабых электролитов.
Количественно процесс электролитической диссоциации выражают с помощью степени диссоциации ( 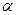 ), т.е. доли молекул, распавшихся на ионы. Степень диссоциации представляют в процентах или в долях единицы:
), т.е. доли молекул, распавшихся на ионы. Степень диссоциации представляют в процентах или в долях единицы:
 ,
,
где n – число молекул, распавшихся на ионы, n0 – общее число растворенных молекул.
Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а)  и
и 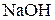 ; б)
; б)  и
и  ; в)
; в)  и
и  ; г)
; г)  и
и  ;
;
д) 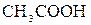 и
и 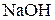 .
.
Решение: запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а)  +
+ 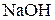 =
=  +
+ 
б)  +
+  =
= 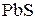
 +
+ 
в)  +
+  =
= 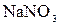 +
+ 
г)  +
+  =
=  +
+ 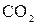 ↑ +
↑ + 
д) 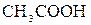 +
+ 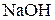 ⇄
⇄  +
+ 
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов ( 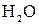 ,
,  ), осадка (
), осадка ( 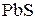 ↓ ), газа (
↓ ), газа ( 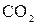 ↑ ).
↑ ).
В реакции (д) имеются два слабых электролита - 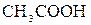 и
и  , но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства: а)
, но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства: а) 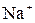 и
и  ; б)
; б) 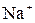 и
и  ; в)
; в) 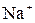 и NO
и NO  ; г) K+ и
; г) K+ и  д)
д) 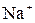 , получим ионно-молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные реакции:
, получим ионно-молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные реакции:
а)  +
+  =
= 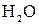
б)  +
+  =
= 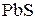
в)  +
+  =
= 
г)  + 2
+ 2  =
= 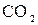 +
+ 
д) 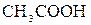 +
+  =
=  +
+ 
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
а) 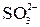 + 2
+ 2  =
=  +
+ 
б)  +
+  =
= 
в)  +
+  =
=  +
+ 
г)  +
+  =
= 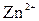 +
+ 
Решение: В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например:
а)  + 2
+ 2  = 2
= 2  +
+  +
+ 
б)  +
+  =
=  + 2
+ 2 
в)  +
+ 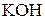 =
=  +
+ 
г)  +
+  =
=  +
+ 
Контрольные вопросы
141. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) хлоридом бария и сульфатом алюминия; б) фосфорной кислотой и нитратом кальция; в) ацетатом калия и серной кислотой.
142. Какое из веществ:  ,
,  ,
,  ,
, 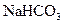 - взаимодействует с раствором гидроксида натрия? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
- взаимодействует с раствором гидроксида натрия? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
143. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) 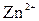 +
+  =
= 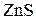 + 2
+ 2 
б)  +
+  =
= 
в)  +2
+2  =
= 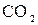 +
+ 
144. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)  и
и 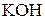 ; б)
; б)  и
и  ; в)
; в)  и
и  .
.
145. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а)  +
+  =
= 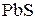 + 2
+ 2 
б) Н б)  + 2
+ 2  =
=  +
+ 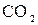
в)  +
+  =
= 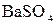
146.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а)  + 2 + 2  = =  + +  + + 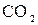 б)
б)  + 2 + 2  = = 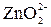 + 2 + 2  в)
в)  + +  = = 
|
147.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а)  + 2 + 2  = =  + 2 + 2  б)
б)  + 2 + 2  = = 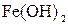 в)
в)  + +  = = 
|
148.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а)  и и 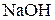 ; б) ; б) 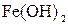 и и  ; в) ; в)  и и  . .
|
149. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)  и и  ; б) ; б)  и и 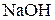 ; в) ; в)  и и 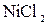 . .
|
150. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)  и и  ;
б) ;
б)  и и 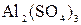 ; в) ; в)  и и 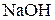 . .
|
151. Составьте молекулярные уравнения реакций взаимодействия в растворах между а)  и и  ; б) ; б)  и и  ; в) ; в)  и и 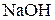 . .
|
152. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между а)  и и  ; б) ; б)  и и 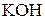 ; в) ; в)  и и 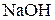 . .
|
153.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)  и и  ; б) ; б)  и и 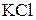 ; в) ; в)  и и  . .
|
154. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) 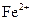 + +    б) б)  + +   
|
155.Какое из веществ:  , , 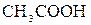 , ,  , ,  - взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. - взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
|
156. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а)  и и  ; б) ; б) 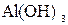 и и 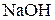 ; в) ; в)  и и  . .
|
157.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)  и и  ; б) ; б)  и и  ; в) ; в)  и и  . .
|
158.Какое из веществ:  , ,  , , 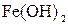 - будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. - будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
|
| 159.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) хлоридом бария и сульфатом алюминия; б) фосфорной кислотой и нитратом кальция; в) ацетатом калия и серной кислотой.
|
| 160. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) сульфидом натрия и соляной кислотой; б) сульфатом железа (II) и сульфидом калия; в) иодидом натрия и нитратом свинца.
|
|
| |
Гидролиз солей
Для решения задач этого раздела рекомендуем воспользоваться литературой 4, 6, 8, 14 и таблицами 4, 5.
Вода является очень слабым электролитом, степень ее диссоциации равна  . Полярные молекулы воды в очень небольшой степени диссоциируют на ионы:
. Полярные молекулы воды в очень небольшой степени диссоциируют на ионы:
 =
=  +
+  ,
,
или с учетом гидратации:
2  =
=  +
+ 
На основании законов химического равновесия получим выражение константы диссоциации воды:
 ,
,
отсюда

По данным измерения электропроводности при температуре 

 , а молярная концентрация чистой воды
, а молярная концентрация чистой воды  . Получаем значение
. Получаем значение 


 Произведение
Произведение  называется ионным произведением воды.
называется ионным произведением воды.
Если  , то концентрация каждого из ионов воды равна
, то концентрация каждого из ионов воды равна  =10-7 моль/л. Ионы водорода являются носителем кислотных свойств, а гидроксид-ионы – щелочных, следовательно, при равенстве их концентраций реакция среды раствора является нейтральной.
=10-7 моль/л. Ионы водорода являются носителем кислотных свойств, а гидроксид-ионы – щелочных, следовательно, при равенстве их концентраций реакция среды раствора является нейтральной.
При  моль/л реакция среды будет кислой, а при
моль/л реакция среды будет кислой, а при  - щелочной. Таким образом, концентрация ионов водорода является мерой его кислотности или щелочности.
- щелочной. Таким образом, концентрация ионов водорода является мерой его кислотности или щелочности.
Более удобен способ выражения реакции среды с помощью отрицательного десятичного логарифма концентрации водородных ионов, именуемого водородным показателем рН:

В нейтральной среде рН = 7; в кислой – рН < 7; в щелочной – рН > 7.
Растворениеразличных веществ в воде часто сопровождается химическим взаимодействием обменного характера. Процессы подобного типа объединяют под общим названием гидролиза. Гидролиз – это химический процесс обменного разложения вещества с водой. Гидролиз солей – частный случай взаимодействия растворенных солей с водой, где их составные части соединяются с составными частями воды с образованием соответствующего слабого электролита.
Реакцию гидролиза соли можно представить общим уравнением:
МА + НОН ⇄ МОН + НА,
Соль вода основание кислота
где М – металл, А – остаток кислоты (анион).
Соли, образованные сильными кислотами и сильными основаниями (например,  ,
,  и др.), гидролизу не подвергаются. Гидролиз характерен для солей, образованных: 1) слабой кислотой и сильным основанием, 2) сильной кислотой и слабым основанием, 3) слабой кислотой и слабым основанием. Приведем примеры.
и др.), гидролизу не подвергаются. Гидролиз характерен для солей, образованных: 1) слабой кислотой и сильным основанием, 2) сильной кислотой и слабым основанием, 3) слабой кислотой и слабым основанием. Приведем примеры.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а)  ; б)
; б)  ; в)
; в)  . Определите реакцию среды растворов этих солей.
. Определите реакцию среды растворов этих солей.
Решение: а) Цианид калия  – соль слабой одноосновной кислоты
– соль слабой одноосновной кислоты 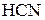 и сильного основания
и сильного основания 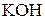 . При растворении в воде молекулы
. При растворении в воде молекулы  полностью диссоциируют на катионы
полностью диссоциируют на катионы  и анионы
и анионы  . Катионы
. Катионы  не будут связывать ионы
не будут связывать ионы  воды, так как
воды, так как 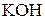 – сильный электролит, анионы же
– сильный электролит, анионы же  связывают ионы
связывают ионы  воды, образуя молекулы слабого электролита
воды, образуя молекулы слабого электролита 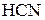 . Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
 +
+  ⇄
⇄ 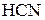 +
+ 
или в молекулярной форме
 +
+  ⇄
⇄ 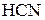 +
+ 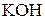
В результате гидролиза в растворе появляется некоторый избыток ионов  , поэтому раствор
, поэтому раствор  имеет щелочную реакцию (pH> 7).
имеет щелочную реакцию (pH> 7).
б) Карбонат натрия  – соль слабой многоосновной кислоты
– соль слабой многоосновной кислоты  и сильного основания
и сильного основания 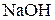 . В этом случае анионы соли
. В этом случае анионы соли  , связывая водородные ионы воды, образуют анионы кислой соли
, связывая водородные ионы воды, образуют анионы кислой соли  , а не молекулы
, а не молекулы  . В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
 +
+  ⇄
⇄  +
+ 
или в молекулярной форме
 +
+  ⇄
⇄ 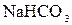 +
+ 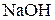
В растворе появляется избыток ионов OH 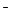 , поэтому раствор
, поэтому раствор  имеет щелочную реакцию (pH> 7).
имеет щелочную реакцию (pH> 7).
в) Сульфат цинка  – соль слабого многокислотного основания
– соль слабого многокислотного основания  и сильной кислоты
и сильной кислоты  . В этом случае катионы
. В этом случае катионы 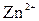 связывают гидроксильные ионы воды, образуя катионы основной соли
связывают гидроксильные ионы воды, образуя катионы основной соли  . Образование молекул
. Образование молекул  не происходит, так как ионы
не происходит, так как ионы  диссоциируют гораздо труднее, чем молекулы
диссоциируют гораздо труднее, чем молекулы  . В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
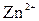 +
+ 
 ⇄
⇄  +
+ 
или в молекулярной форме
2  + 2
+ 2  ⇄
⇄  +
+ 
В растворе появляется избыток ионов водорода, поэтому раствор  имеет кислую реакцию (pH< 7).
имеет кислую реакцию (pH< 7).
Пример 2. Какие продукты образуются при смешивании растворов  и
и  ? Составьте ионно-молекулярное и молекулярное уравнение реакции.
? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение: Соль  гидролизуется по катиону, а
гидролизуется по катиону, а  – по аниону:
– по аниону:
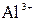 +
+  ⇄
⇄  +
+ 
 +
+  ⇄
⇄  +
+ 
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы  и
и  образуют молекулу слабого электролита
образуют молекулу слабого электролита  . При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием
. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием 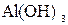 и
и 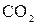 (
(  ). Ионно-молекулярное уравнение:
). Ионно-молекулярное уравнение:
 +
+  +
+ 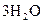 =
=  +
+ 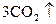
молекулярное уравнение:
2  + 3
+ 3  +3
+3  = 2
= 2 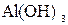 + 3
+ 3 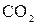 + 6
+ 6 
Контрольные вопросы
161. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию.
162. Kакое значение  имеют растворы следующих солей:
имеют растворы следующих солей:  ,
,  ,
,  ? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
163. Какие из солей  ,
, 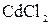 ,
, 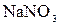 ,
, 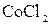 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение
подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение  имеют растворы этих солей?
имеют растворы этих солей?
164. При смешивании растворов  и
и  каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
165. Какая из двух солей при равных условиях в большей степени подвергается гидролизу:  или
или  ,
, 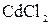 или
или  ? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
166. Какое значение  имеют растворы солей
имеют растворы солей  ,
,  ,
,  ? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
167. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей  , ,  , ,  . Какое значение . Какое значение  имеют растворы этих солей? имеют растворы этих солей?
|
168. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей  , ,  , ,  . Какое значение . Какое значение  имеют растворы этих солей? имеют растворы этих солей?
|
169. При смешивании растворов  и и  каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнения происходящего совместного гидролиза. каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнения происходящего совместного гидролиза.
|
170. Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений:
 + 2 + 2  ⇄ ⇄  +2 +2 
 + +  ⇄ ⇄  + + 
| |
171. Какие из солей 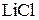 , ,  , ,  , , 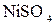 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение  имеют растворы этих солей? имеют растворы этих солей?
|
172. К раствору  добавили следующие вещества: а) добавили следующие вещества: а)  ; б) ; б) 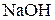 ; в) ; в)  ; г) ; г)  . В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. . В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
| |
173. Какая из двух солей при равных условиях в большей степени подвергается гидролизу:  или или  ; ;  или или  ? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. ? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
| |
174. Какое значение  имеют растворы солей имеют растворы солей 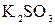 , ,  , ,  ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
| |
175.Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений:
 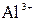 + +  ⇄ ⇄ 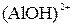 + + 
 + +  ⇄ ⇄  + + 
| |
176. К раствору  добавили следующие вещества: а) добавили следующие вещества: а)  ; б) ; б) 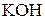 ; в) ; в)  ; г) ; г)  . В каких случаях гидролиз сульфида натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. . В каких случаях гидролиз сульфида натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
| |
177. Cоставьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов  и и  . Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. . Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
| |
178. К раствору 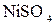 добавили следующие вещества: а) добавили следующие вещества: а)  ; б) ; б) 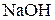 ; в) ; в) 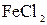 ; г) ; г)  . В каких случаях гидролиз cульфата никеля усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. . В каких случаях гидролиз cульфата никеля усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
| |
179. Какие из солей 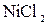 , ,  , ,  , , 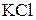 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение  имеют растворы этих солей? имеют растворы этих солей?
| |
180. При смешивании растворов  и и  каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
| |
Задания к контрольной работе №2
Популярное:

