
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Волокнистые материалы как объект колорирования
В сухом состоянии все волокнистые материалы, как природные, так и химические, не обладают системой субмикроскопических пор, достаточных для проникновения в них молекул красителей. Размеры пор в сухих волокнах не превышают 0, 2–0, 5 нм. При погружении гидрофильных волокон в воду и водные растворы происходит их смачивание, а затем набухание. Это приводит к увеличению внутренней поверхности, подготавливая волокнистый материал к восприятию красителя. Внутренняя адсорбционная поверхность определяет “услов-ный объем”, в котором осуществляются процессы массопереноса и взаимодействия молекул красителя с функциональными группами волокна. Размер субмикроскопических пор в набухших волокнах составляет 3–7 нм. Несмотря на то что размеры молекул красителей значительно превосходят размеры молекул воды, внутренний объем, возникающий в результате набухания гидрофильных волокон, вполне достаточен для размещения молекул красителя. Во внутреннем объеме гидрофильных волокон размещаются не только одиночные молекулы красителя, но и их ассоциаты и иногда даже кристаллы. Способность натуральных и химических волокон к набуханию в воде зависит от гидрофильности полимера, плотности упаковки макромолекулярных цепей, т.е. от степени готовности этих цепей к межмолекулярному взаимодействию. Для волокон из гидрофильных полимеров (хлопка, льна, вискозных, медноаммиачных), а также в некоторой степени для поливинилспиртовых и полиамидных волокон межмолекулярные взаимодействия ослабляются при обработке волокон водой или другими соединениями, содержащими гидроксильные группы (растворами щелочей, спиртов, фенолов и т. п.). Такие же изменения наблюдаются при обработке ацетатных и полиэфирных волокон кетонами, фенолами, концентрированными растворами некоторых органических кислот, при обработке полиакрилонитрильных волокон диметилформамидом и амидами других кислот или концентрированными растворами лиофильных солей и минеральных кислот. Во всех перечисленных случаях происходит сольватация активных функциональных групп волокнообразующего полимера, ослабляются межмолекулярные взаимодействия, и макромолекулы или отдельные сегменты макромолекул приобретают способность изменять свою ориентацию в волокне и занимают положение, благоприятное для проникновения молекул или ионов красителей. Важным фактором, определяющим поведение волокнистого материала в процессах крашения водными растворами красителей, являются электрокинетические свойства поверхности этих волокон. Большинство волокнистых материалов, будучи погруженными в водный раствор, приобретают отрицательный заряд, который в очень сильной степени зависит от вида волокна, его предварительной подготовки и степени окисления исходных функциональных групп. Возникновение заряда обусловлено, отчасти, диссоциацией соответствующих функциональных групп волокна и, главным образом, неравномерным поглощением волокном из раствора гидроксильных и водородных ионов. Значения электрокинетического потенциала для различных текстильных волокон колеблются от 12–15 до 75–80 мВ. Обычно действие сил электростатического отталкивания распространяется на расстояние ~10 нм от отрицательно заряженной поверхности волокна. Силы же взаимного притяжения анионов красителей и соответствующих активных участков или функциональных групп волокна проявляют свое специфическое влияние только при сближении реагирующих компонентов на расстояние до 0, 2–0, 5 нм. Поэтому для нормального протекания адсорбции красителя и формирования поверхностного граничного слоя необходимо экранировать влияние сил электростатического отталкивания. Для этого в красильную ванну добавляют нейтральный электролит или изменяют соответствующим образом рН раствора. Количество электролита и кислотность среды необходимо регулировать очень строго, так как при избытке электролита лишенные отрицательного заряда частицы красителя легко ассоциируют в крупные агрегаты, неспособные непосредственно участвовать в образовании поверхностного слоя и, тем более, в процессе перераспределения красителя из этого слоя внутрь волокна. При наличии в растворе соли электрический потенциальный барьер резко снижается и анионы красителя могут приблизиться к поверхности волокон на такое расстояние, на котором уже начинают действовать силы взаимного притяжения, и краситель поглощается волокнистым материалом. Попав на волокно, краситель повышает его отрицательный заряд и тем самым может сдерживать дальнейшую адсорбцию. Для предотвращения этого нежелательного явления адсорбция анионов красителей должна сопровождаться поглощением эквивалентного количества противоионов, чаще всего ионов натрия, компенсирующих отрицательный заряд красителя. Таким образом, компенсирующие ионы становятся частью красильной системы, и без них эта система не может активно функционировать. Следовательно, нейтральный электролит нужен не только для снижения потенциального энергетического барьера (рис. 3) при перемещении аниона красителя к поверхности волокна, но и как источник компенсирующих ионов, необходимых для адсорбции красителя. Гидрофобные синтетические волокна отличаются от гидрофильных природных и химических волокон прежде всего тем, что они не набухают в воде и водных растворах, поэтому требуются какие–то иные способы повышения восприимчивости гидрофобных синтетических волокон к красителям, например повышение температуры. В обычных условиях (20–25 °С) макромолекулы термопластичных синтетических полимеров находятся как бы в замороженном, застеклованном состоянии и их звенья, фрагменты не способны к каким–либо перемещениям.
Повышение температуры до определенного значения приводит к расстекловыванию полимера, т. е. возникает явление сегментальной подвижности макромолекул, что обеспечивает образование в аморфных областях волокна свободных пространств, достаточных для прохода молекул красителя. Температура, при которой происходит изменение сегментальной подвижности макромолекул волокнообразующего гидрофобного полимера, называется температурой стеклования. О том, насколько эффективен температурный фактор при крашении гидрофобных синтетических волокон в водной среде, можно судить по следующим экспериментальным данным. При 100 °С коэффициент диффузии красителя в полиэфирном волокне, характеризующий скорость проникновения красителя в волокно, составляет 10–12–10–13 см2/с. Повышение температуры до 150–230 °С приводит к увеличению этого показателя до 10–8–10–9 см2/с. С примерно такими же скоростями диффундируют красители в набухшие в воде гидрофильные волокна при 100 °С. Другим эффективным средством активирования гидрофобных синтетических волокон является замена обычной водной среды, предназначенной для проведения крашения, на систему специально подобранных органических растворителей. Эти растворители действуют на гидрофобные волокнообразующие полимеры так же, как вода на гидрофильные. Проникая внутрь гидрофобных волокон, растворители сольватируют их макромолекулы, вследствие чего повышается подвижность структурных элементов полимера, происходит эффективное и обратимое набухание волокна, сопровождающееся образованием системы субмикроскопических пор, вполне достаточных для диффузии молекул красителя и размещения его в возникающих свободных объемах надмолекулярной структуры волокнистого материала. Например, если проводить крашение полиэфирного волокна не в водной среде, а в дихлорметане, то коэффициент диффузии красителя в волокне при 25 °С равен 10–9 см2/с, что соответствует коэффициенту диффузии при температуре 200–220 °С. Это означает, что дихлорметан, сольватируя макромолекулы волокна, уже при 25 °С производит тот же самый эффект активирования полиэфира, как и воздействие тепла при 220 °С.
Растворы красителей
Растворы красителей в воде обычно представляют собой поли-дисперсные системы, в которых в состоянии подвижного равновесия одновременно присутствуют молекулы, ионы и их смешанные ассоциаты различного состава. Состояние подвижного равновесия в таких системах зависит прежде всего от природы красителя, способности его молекул к электролитической диссоциации на ионы, от наличия или отсутствия в составе молекул группировок, определяющих тенденцию диссоциированных или недиссоциированных окрашенных частиц к ассоциации. Смещение подвижного равновесия в распределении окрашенных частиц в растворе по их дисперсности возможно и при действии внешних факторов, таких, как температура, концентрация красителя и электролита в растворе, наличие или отсутствие в нем текстильных вспомогательных веществ, растворителей и других препаратов, используемых при крашении. На состояние подвижного равновесия в растворе существенное влияние оказывает и окрашиваемый волокнистый материал. Помещенное в раствор красителя волокно действует как молекулярное сито, избирательно поглощая только ионы и молекулы красителя, так как ограниченный размер субмикроскопических пор в волокне не позволяет проникать в него крупным ассоциатам красителя. Уменьшение концентрации ионов и молекул красителя в растворе нарушает состояние равновесия в статистическом распределении окрашенных частиц по их размерам и приводит к распаду крупных ассоциатов красителя на более мелкие, вплоть до молекул или ионов. При характеристике состояния красителей в растворе лучше всего было бы знать действительную картину изменения содержания в нем окрашенных ионов, молекул и их ассоциатов при изменении температуры, концентрации красителя и электролита, рН раствора, добавлении текстильных вспомогательных веществ. Однако на практике такой дисперсионный анализ красильных растворов в настоящее время невозможен. Поэтому оценивают лишь тенденцию красителей к образованию в растворе ассоциатов большей или меньшей величины. Для этого определяют «степень ассоциации» (А), которая показывает, из скольких молекул или ионов состоит ассоциированная частица красителя. Тенденция к ассоциации и строение возникающих ассоциатов зависят от многих факторов и, в частности, от природы красителя и наличия в растворе других компонентов. Силы, вызывающие ассоциацию красителя, во многом аналогичны тем силам, которые действуют между волокном и красителем и обусловливают избирательную адсорбцию красителя из раствора волокнистыми материалами в процессах крашения. Это силы Ван–дер–Ваальса, водородные связи, дисперсионные силы. Так, напри-мер, в образовании ассоциированных частиц приведенного ниже прямого красителя участвуют водородные связи:
При увеличении концентрации красителя в растворе и особенно при введении в него постороннего электролита, например хлорида натрия, возрастают размеры ассоциатов и уменьшается содержание ионов и отдельных молекул, так как при этом резко подавляется диссоциация полярных групп, чаще всего сульфогрупп, в молекуле красителя. В результате снижается одноименный заряд ионов красителя и ослабевают силы их взаимного отталкивания. Повышение температуры, напротив, приводит к дезагрегации красителя. При высоких температурах происходит разрыв связей между отдельными молекулами или ионами красителя, входящими в ассоциат, и, соответственно, резко повышается концентрация ионов красителя в растворе. Такая зависимость наблюдается для красителей, имеющих как ионное, так и неионное строение. Различия проявляются только в абсолютных значениях растворимости и в температурах, при которых краситель переходит из ассоциированного состояния в неассоциированное. Наличие в водных растворах красителей текстильных вспомогательных веществ и некоторых гидрофильных органических растворителей тормозит процессы образования ассоциированных частиц красителей даже при высоких концентрациях их в растворе и при введении в него нейтрального электролиза. Введение в водный раствор красителя гидрофильных растворителей или текстильных вспомогательных веществ изменяет природу ассоциированных частиц. Высокосольватированные ионы и молекулы красителей утрачивают способность к образованию крупных ассоциатов. Это в свою очередь сказывается на диффузионной подвижности красителя в растворе и на его способности взаимодействовать с волокнистыми материалами. Вначале под влиянием гидрофильных растворителей диффузионная подвижность красителей возрастает, а затем, достигнув максимума, медленно снижается. Это объясняется тем, что уже небольшие добавки растворителей разрушают крупные ассоциаты красителей. Увеличение же содержания гидрофильных растворителей в растворе приводит к возрастанию степени сольватации молекул или ионов красителей, выделившихся из состава ассо-циатов, и замедлению вследствие этого диффузии сольватированных частиц. При переходе от водных растворов к неводным прежде всего резко сужается ассортимент красителей, способных растворяться в гидрофобных растворителях и других неводных средах. Наиболее изучены в настоящее время неводные растворы неионных дисперсных красителей. Эти красители при 20–50 °С в воде практически нерастворимы, но очень хорошо растворяются в различных гидрофобных органических растворителях, причем тем лучше, чем выше полярность растворителя. Спектрофотометрические исследования и изучение диффузии красителей в неводных средах показало, что агрегатное состояние красителей в гидрофобных растворителях и водных растворах различно. В неводной среде красители практически не ассоциированы и не образуют полидисперсных систем. Рассчитанные по коэффициентам диффузии условные радиусы частиц очень близко соответствуют теоретическим размерам молекул дисперсных красителей, определенным по межатомным расстояниям в соответствии со строением молекулы красителя. Большая часть красителей (прямые, кислотные, активные, катионные) в отличие от дисперсных практически полностью нерастворимы в гидрофобных органических растворителях. Эти красители можно перевести в неводный раствор только с помощью сорастворителей, например некоторых спиртов, диметилформамида, диметилсульфоксида. Наиболее универсальным неводным растворителем является жидкий аммиак. Он легко и быстро растворяет красители многих классов с образованием молекулярно–дисперсных растворов. Жидкий аммиак совмещается со многими гидрофильными и гидрофобными органическими растворителями.
Процессы крашения
Крашение текстильных материалов представляет собой самопроизвольный переход молекул или ионов красящего вещества из раствора в волокно. Поскольку этот процесс осуществляется в гетерогенной среде, его можно условно подразделить на несколько физико–химических стадий: диффузию и конвективный перенос красителя в растворе к поверхности волокна, адсорбцию молекул красителя этой поверхностью и диффузию их внутрь волокнистого материала. Вполне естественно, что в реальных процессах крашения все названные выше стадии осуществляются одновременно и четких границ между ними не существует. Роль каждой стадии не всегда однозначна и определяется условиями проведения процесса крашения, природой красящего вещества и окрашиваемого волокна, а также средой, в которой осуществляется этот процесс. Переход красителя из раствора в волокно. С определенной степенью приближения любой волокнистый материал можно представить в виде модели, которая состоит из волокон, пронизанных системой субмикроскопических пор, и межволоконных пространств. При погружении волокнистого материала в красильную ванну в первый момент происходит впитывание раствора и заполнение им межволоконных пространств. Одновременно начинается расширение субмикроскопических пор в волокне вследствие его набухания. Из раствора, непосредственно прилегающего к поверхности волокна, краситель постепенно проникает внутрь волокна через раскрывающиеся при набухании субмикроскопические поры. В результате поверхностный микрослой раствора обедняется красителем, и для успешного протекания процесса крашения его необходимо непрерывно пополнять молекулами красителя путем диффузии их из внешнего раствора или конвективного обмена путем перемешивания. Чем эффективнее перемешивание, тем менее важна стадия диффузии красителя в растворе. Коэффициент диффузии в растворе составляет 10–5–10–6 см2/с. Ускорить процесс диффузии можно только путем повышения температуры, вызывающего снижение вязкости раствора, уменьшение степени ассоциации частиц красителя и повышение кинетической энергии молекул или ионов красителя, выделившихся из состава ассоциатов. При использовании водных растворов красителей повышение температуры на каждые 10 °С приводит в зависимости от степени начальной ассоциации красителя к возрастанию скорости его диффузии на 20–30 %. В отличие от молекулярной диффузии красителя в растворе конвективный обмен обедненных слоев красильного раствора можно производить с любой степенью интенсивности. На практике конвективный обмен раствора красителя вблизи поверхности окрашиваемых волокон осуществляют путем вакуум–прососа или прокачивания раствора красителя через окрашиваемый материал. Используют также принцип эжекции красильного раствора и перемешивания его током воздуха или пара. Хорошие результаты достигаются при создании у поверхности волокнистой массы турбулентных и пульсирующих потоков красильного раствора. Для этого окрашиваемый волокнистый материал пропускают с большой скоростью через красильную ванну, выполненную в форме узких щелей, заполненных раствором красителя. Существуют и другие способы эффективного обмена раствора красителя вблизи поверхности волокна. Особенно заметно сказывается перемешивание раствора красителя при непрерывных процессах крашения, когда время пребывания окрашиваемого материала в красильной ванне очень невелико и исчисляется секундами и даже долями секунды. В этих условиях краситель, находящийся во внешнем растворе, в основном не принимает участие в процессе крашения, так как его молекулы за малый промежуток времени нахождения волокна в красильной ванне не успевают продиффундировать через увлекаемые волокнистым материалом слои обедненного раствора и достичь поверхности волокон. Поэтому при непрерывных способах крашения конвективный обмен поверхностных слоев красильного раствора совершенно необходим. Из двух других физико–химических стадий процесса крашения — адсорбции молекул красителя поверхностью волокна и диффузии их внутри волокнистого материала — наиболее медленной является стадия диффузии и в большинстве известных технологических процессов она определяет общее содержание и распределение красителя в волокне. Адсорбция красителей волокнистыми материалами. Движущую силу самопроизвольного перехода молекул красителя из красильного раствора в волокно при погружении его в красильную ванну обычно выражают в виде разности химических потенциалов красителя в волокне и в растворе в стандартных условиях, иными словами, стандартным сродством красителя к волокну (уравнение 47).
где –Dm0 — сродство красителя к волокну, т. е. изменение энергии Гиббса (в кДж/моль) системы при переходе красителя из красильного раствора в волокно; R — универсальная газовая постоянная; Т — температура; К — константа адсорбционного равновесия. В общем случае величина К характеризует распределение красителя между раствором и волокном в момент достижения равновесия в красильной системе и равна отношению соответствующих активностей (уравнение 48).
где Ав и Ар — активность красителя соответственно в волокне и в растворе. Действительное распределение красителей различных классов в разнообразных волокнистых материалах, которое достигается в процессе адсорбции, неизвестно, поэтому в зависимости от принятого в каждом конкретном случае механизма процесса крашения величины Ав и Ар могут быть выражены по–разному. 1. В простейшем варианте величины Ав и Ар приравниваются к соответствующим концентрациям красителя в волокне и в растворе. При этом предполагают, что в обеих фазах краситель не диссоциирован. Стандартное сродство красителя к волокну в этом случае может быть вычислено по уравнению (49).
где [Кр]в и [Кр]р — равновесные концентрации красителя в волокне и растворе в моль/кг и моль/л, соответственно. Если обозначить [Кр]в/[Кр]р через К, то уравнение (49) примет вид (50).
В реальной практике крашения такой процесс адсорбции наиболее близко отвечает крашению гидрофобных синтетических волокон дисперсными красителями. Равновесные изотермы адсорбции в этом случае имеют линейный вид, и коэффициент распределения красителя между фазами волокна и раствора является величиной постоянной, численно равной тангенсу угла наклона таких прямых. Принято считать, что адсорбированный по этому механизму краситель образует в фазе гидрофобного волокна твердый раствор, т. е. переходя из красильной ванны в волокно, краситель как бы растворяется в нем. Однако такой процесс с равным успехом можно относить и к типично адсорбционным, когда степень насыщения волокна молекулами дисперсного красителя очень невысока. Краситель в волокне удерживается силами Ван–дер–Ваальса, водородными связями и диполь–дипольным взаимодействием. 2. Если краситель типа КрNаz полностью диссоциирован в растворе и в волокне на ионы Крz– и ионы натрия, которые в процессе адсорбции диффузно распределяются в эффективном объеме волокна, то активность красителя в растворе и в эффективном объеме волокна выражается в этом случае через произведения концентраций соответствующих ионов (уравнения 51, 52).
где [Крz–]в и [Nа+]в — концентрации анионов красителя и катионов натрия в волокне, моль/кг; [Крz–]р и [Nа+]р — концентрации тех же ионов в растворе, моль/л; z — заряд аниона красителя; V — эффективный объем волокна, л/кг, т. е. объем, доступный для диффузного размещения в волокне анионов красителя и компенсирующих ионов натрия. Движущая сила переноса ионов из красильной ванны в эффективный объем волокна определяется в этом случае уравнением (53).
Уравнение (53) вполне подходит для описания процесса адсорбции большинства красителей анионного типа различными целлюлозными волокнами. При этом необходимо, чтобы процесс поглощения красителя волокном был обратимым. При использовании активных или кубовых красителей требование соблюдения равновесности процесса адсорбции выполняется не на всех стадиях технологического цикла крашения. Оно нарушается при фиксировании активного красителя целлюлозой с образованием ковалентной связи и при переводе лейкосоединений кубовых красителей в волокне в нерастворимое состояние. Расчет сродства по уравнению (53) основан на допущении, что в процессе крашения переход анионов красителя из раствора в волокно обусловлен одновременным действием двух типов сил: сил избирательного притяжения анионов красителя к активным центрам волокна в пределах его эффективного объема и сил электростатического отталкивания этих анионов от одноименно заряженной поверхности волокна. В результате проявления действия этих противоположных влияний и устанавливается диффузное распределение анионов красителя в эффективном объеме волокна. Ионы натрия локализуются в нем для компенсации отрицательного заряда, возрастающего в результате адсорбции анионов красителя. Концентрацию ионов натрия в волокне, необходимую для вычисления сродства анионов красителя к целлюлозе, обычно рассчитывают по уравнению (54).
где [Сl–]p — концентрация в растворе ионов хлора, которые образуются в результате диссоциации хлорида натрия, используемого при крашении в качестве нейтрального электролита. Соответствующие эффективные объемы (см. уравнения 51 и 53) составляют (в л/кг): 0, 3 (хлопок), 0, 45 (вискозное волокно и мерсеризованный хлопок), 0, 65 (медноаммиачное волокно). При наличии в красильной ванне одновременно неокрашенных анионов нескольких типов, как, например, при крашении целлюлозных волокон кубовыми красителями по восстановительному способу, в уравнение (54) необходимо ввести соответствующую поправку: вместо концентрации ионов хлора [Сl–]p нужно брать суммарную концентрацию всех имеющихся в растворе неорганических анионов ([Сl–]p + 2[S2О42–]p + K[ОН–]р). Если считать, что анионы красителя локализуются в эффективном объеме волокна не диффузно, а адсорбируются в форме мономолекулярного слоя, то активность красителя в фазе волокна Aв следует выражать как функцию числа занятых им активных центров qкр (уравнение 55). В этом случае уравнение (53) принимает вид (56).
При этом предусматривается, что при мономолекулярной адсорбции анионов красителя в волокне катионы натрия распределяются в нем диффузно. 3. Если в волокне имеются диссоциированные амино– и карбоксигруппы, способные обратимо реагировать с соответствующими анионами красителя и катионами водорода
то выражения для активности красителя в фазах волокна и раствора принимают следующий вид:
По мере протекания процесса хемосорбции прореагировавшие с анионами красителя аммонийные группы «выбывают» из сферы реакции, и в тот момент, когда прореагируют все группы, наступает насыщение волокна красителем. Степень завершенности реакции и весь ход процесса адсорбции регулируется концентрацией водородных ионов в системе. При их избытке подавляется диссоциация всех карбоксильных групп волокна, а аминогруппы приобретают положительный заряд. Только в этом случае достигается максимальное поглощение красителя волокном. Для белковых волокон шерсти и шелка максимальное поглощение красителей анионного типа составляет соответственно 0, 8–0, 9 и 0, 2–0, 3 моль/кг, для полиамидных оно равно 0, 04–0, 06 моль/кг. Это позволяет вычислить значения Сродство красителей анионного типа, в первую очередь кислотных красителей, к белковым, полиамидным и другим волокнам, содержащим аминогруппы, может быть определено по уравнению (59).
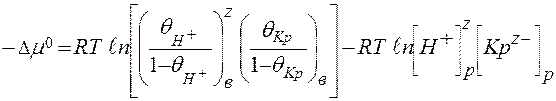
В ряде частных случаев это уравнение очень упрощается. Например, если допустить, что краситель является одноосновной кислотой КрSОзН, т. е. z = 1 и [Н+]p = [Кр]p, и что число активных центров в волокне, предназначенных для поглощения анионов красителя, равно числу активных центров для поглощения ионов водорода
Если, кроме того, ограничиться рассмотрением только такого варианта сорбции, когда поглощение красителя волокном составляет 50 % от максимально возможного поглощения, то
Это означает, что для определения сродства одноосновного кислотного красителя к белковому волокну достаточно экспериментально измерить значение рН красильного раствора, соответствующее достижению половинного уровня насыщения волокна красителем. Чаще всего значение (рН)р находят графически (см. рис. 20 а). В том случае, если окрашиваемое волокно содержит в качестве активных группировок для хемосорбции красителя карбоксигруппы и если оно способно поглощать одновременно с одновалентными катионами красителя и соответствующие неорганические анионы (Х–), уравнение (62) для расчета сродства мало отличается от уравнения (59).
Если сорбция катионного красителя волокном проходит по схеме
то константа равновесия этого процесса может быть выражена следующим образом:
Суммарная концентрация катионов красителя и ионов водорода в волокне должна быть равна общему содержанию в нем кислотных групп
Уравнения (62) и (64) используют при интерпретации результатов равновесного крашения полиакрилонитрильных волокон катионными красителями. В подавляющем большинстве известных технологических процессов крашения различных волокнистых материалов взаимодействие красителя с полимером происходит с выделением тепла. Это означает, что при повышении температуры процесса адсорбционное равновесие
будет сдвигаться влево, т. е. в сторону понижения накрашиваемости. С повышением температуры снижается также значение Все сказанное относится только к такому процессу крашения, который доведен до состояния равновесия, когда при длительном времени пребывания волокна в красильной ванне скорости адсорбции красителя волокном и десорбции его из волокна выравниваются. В реальных же процессах крашения, когда волокно находится в красильном растворе в течение очень ограниченного времени, состояние равновесия практически никогда не достигается, и влияние температуры на результаты крашения может проявляться по–разному в зависимости от степени удаленности процесса от состояния равновесия. Чаще всего в реальных процессах крашения, особенно если они проводятся по непрерывной схеме, повышение температуры приводит не к понижению, а к возрастанию накрашиваемости волокнистых материалов. Происходит это потому, что повышение температуры одновременно сказывается как на адсорбционной, так и на диффузионной стадиях общего физико–химического цикла крашения. Под влиянием температуры эффективность адсорбции снижается, скорость же диф-фузии резко возрастает, и если процесс сильно удален от состояния равновесия, то накрашиваемость волокна увеличивается. Как отмечалось ранее, гидрофильные органические растворители и текстильно–вспомогательные вещества сольватируют молекулы или ионы красителя, что затрудняет их адсорбционное взаимодействие с волокном. В результате этого как и при повышении температуры адсорбционное равновесие смещается влево, уменьшается сродство красителя к волокну и снижается равновесная накрашиваемость. Если же процесс крашения не доведен до состояния равновесия, то в зависимости от концентрации вспомогательных веществ в красильном растворе можно наблюдать либо повышение, либо понижение накрашиваемости. В отличие от действия температуры, гидрофильных растворителей и текстильных вспомогательных веществ введение в красильную ванну электролитов приводит к смещению адсорбционного равновесия вправо. Это наблюдается при крашении целлюлозных волокон прямыми и некоторыми другими красителями. Однако при большом избытке электролита в красильной ванне происходит ассоциация красителя, которая тем выше, чем ниже температура крашения. Поэтому эффективность адсорбции и общая накрашиваемость волокна возрастают при небольшом содержании электролита в растворе и уменьшаются при таких его концентрациях, когда начинается ассоциация молекул или ионов красителя и замедляется вследствие этого их диффузия в волокно. Важно отметить, что хотя равновесное распределение красителя между волокном и раствором и смещается под действием электролита в сторону волокна, сродство красителя к волокну при этом практически не изменяется. Это обусловлено тем, что наличие нейтральной соли в красильной ванне увеличивает концентрацию ионов натрия как в растворе, так и в волокне. В результате возрастают соответствующие значения активности красителя в волокне и растворе (см. уравнения 51, 52), отношение же их и, следовательно, значения К и Влияние температуры, гидрофильных органических растворителей, текстильных вспомогательных веществ и электролитов на общие результаты крашения будут рассмотрены при описании физико–химической сущности технологических процессов крашения конкретных волокнистых материалов красителями различных классов. Зависимость сорбции красителя волокном от температуры чаще всего характеризуется тепловым эффектом и изменением энтропии этого процесса. Тепловой эффект с определенными ограничениями характеризует прочность связи красителя с функциональными группами волокнообразующего полимера. Эти ограничения обусловлены тем, что тепловой эффект адсорбции включает не только те тепловые изменения в системе, которые соответствуют образованию какой–либо связи между красителем и полимером, но и ряд других составляющих, таких, как тепловой эффект дегидратации волокна и молекул или ионов красителя, разрыва межмолекулярных связей в волокне, ассоциации и распада ассоциатов красителей. Для расчета тепловых эффектов адсорбции красителей волокнистыми материалами
После интегрирования уравнения (65) при допущении, что тепловой эффект не зависит от температуры, получим уравнение (66).
где температурах крашения По значениям сродства красителя к волокну и теплового эффекта адсорбции можно вычислить изменение энтропии
Популярное:
|
Последнее изменение этой страницы: 2017-03-11; Просмотров: 1186; Нарушение авторского права страницы