
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
СХЕМА ФАЗОВЫХ ПРЕВРАЩЕНИЙ ОДНО КОМПОНЕНТНЫХ
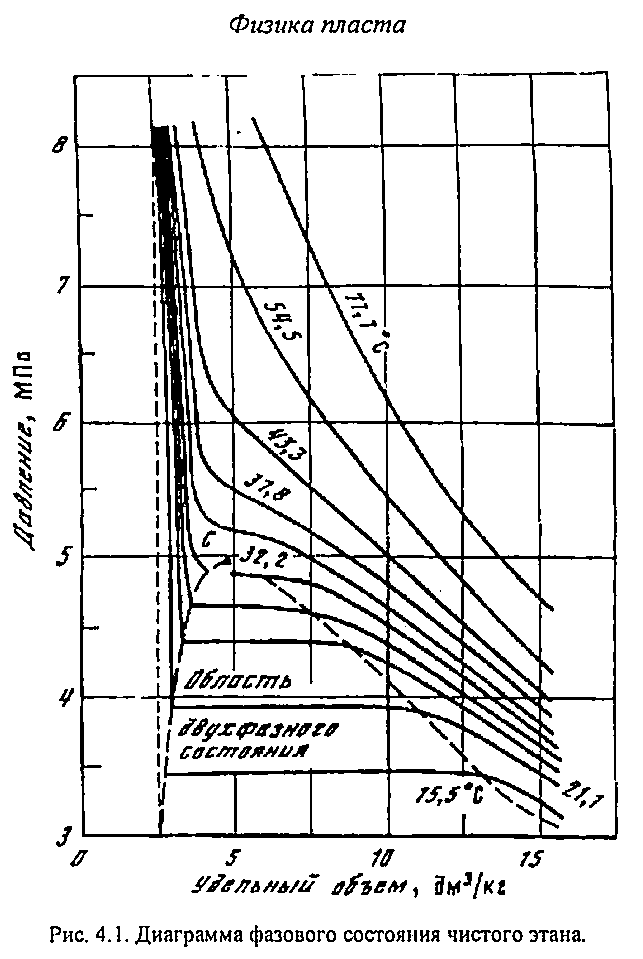
СИСТЕМ Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объем при изменении давления и температуры. На рис. 4.1 представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазам изменениям при постоянной температуре и имеет три участка. Слева от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок пунктирной газожидкостной области, левый участок - жидкой фазе. Отрезок й линии вправо от максимума в точке С называется кривой точек *и (или точек росы), а влево от максимума - кривой точек парообразования В точке С пунктирной линии кривые парообразования и конденсации Эта точка называется критической : 6лижением температуры и давления к критическим значениям свойства 1кой фаз становятся одинаковыми, поверхность раздела между ними плотности их уравниваются. Следовательно, с приближением к точке по кривой начала кипения плотность жидкой фазы будет бывать. Если же к ней приближаться по линии точек конденсации, то.будет непрерывно возрастать.
Для индивидуальных углеводородов граничным давлением между жидкой и газовой фазой является давление упругости паров (при данной температуре), при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью. Фазовые превращения углеводородов можно также представить в координатах давление-температура (рис. 4.2). Для однокомпонентной системы кривая давления насыщенного пара на графике давление-температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах вещество находится в однофазном состоянии. Фазовая диаграмма индивидуальных углеводородов ограничивается критической точкой С (рис. 4.2). Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых ещё могут существовать две фазы одновременно.
Из рисунка 4.2 следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки А (рис. 4.2), можно изобарически нагреть до температуры точки В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки D, расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки D до точки Е), а затем при снижении давления до точки F вещество приобретёт свойства жидкости, минуя область двухфазного состояния. Значительно сложнее закономерности фазовых переходов двух- и многокомпонентных систем. В смеси углеводородов каждый компонент имеет собственные значения упругости насыщенных паров, поэтому процессы конденсации и испарения не будут происходить при конкретных значениях давления и температуры, а в определённом диапазоне значений давления и температуры. Границы диапазона будут тем больше, чем больше разница между критическими значениями давления и температуры индивидуальных компонентов, входящих в систему. Более подробную информацию по фазовым переходам многокомпонентных систем можно найти в литературе [3, 4].
4.2. ФАЗОВЫЕ ПЕРЕХОДЫ В НЕФТИ, ВОДЕ И ГАЗЕ Фазовые переходы подчиняются определённым закономерностям, в основе которых лежит понятие равновесия фаз. Равновесие фаз характеризуется константой равновесия, которая зависит от температуры и давления. Константа фазового равновесия i-ro компонента характеризуется отношением мольной доли компонента в газовой фазе (yt или Nyj) к мольной доле этого компонента в жидкой фазе (х; или Nxi), находящейся в равновесном состоянии с жидкой фазой:
Для определения равновесного состояния газожидкостных смесей используются законы Дальтона и Рауля. Согласно закону Дальтона каждый компонент, входящий в газовую фазу имеет своё парциальное давление Pi, а общее давление в газовой системе равно сумме парциальных давлений:
Согласно закону Рауля, парциальное давление компонента над жидкостью (нефтью) равно давлению насыщенного пара (Рнас пара) или упругости пара (Qi) и этого компонента, умноженному на его мольную долю в нефти: где Qi - упругость паров компонента; Hxi - мольная доля компонента Piнаспара - давление насыщенного пара i-ro компонента. В момент равновесия парциальное давление i-ro компонента в газовой фазе равно парциальному давлению компонента над жидкостью. Отсюда следует закон Дальтона-Рауля для равновесного состояния газовой и нефтяной фазы :
где Ki - константа равновесия i-ro компонента при данной температуре и давлении смеси. Уравнение материального баланса для одного моля нефтегазовой смеси:
Используя уравнения (4.6) и (4.7) получим выражение для мольной доли компонента жидкой фазы:
и для мольной доли компонента газовой фазы:
5. ПОВЕРХНОСТНО-МОЛЕКУЛЯРНЫЕ СВОЙСТВА СИСТЕМЫ ПЛАСТ-ВОДА
Нефтяной пласт представляет собой залежь осадочных, пород в виде тела с огромным скоплением капиллярных каналов и трещин, поверхность которых очень велика. Поэтому закономерности движения нефти в пласте и её вытеснения из пористой среды зависят также и от свойств пограничных слоев соприкасающихся фаз и процессов, происходящих на поверхности контакта нефти, газа и воды с породой. На формирование залежей углеводородов оказывает влияние количество остаточной воды в залежи (остаточная водонасыщенность, SB), которая в свою очередь зависит от свойств воды и углеводородов и от природы поверхности горной породы. Под природой поверхности понимаются гидрофильность - способность вещества смачиваться водой и гидрофобность - способность вещества не смачиваться водой. Физико-химические свойства поверхностей раздела фаз и закономерности их взаимодействия характеризуются рядом показателей - поверхностным натяжением на границе раздела фаз, явлениями смачиваемости и растекания, работой адгезии и когезии, теплотой смачивания. Поверхностное натяжение Поверхностное натяжение связано с такими понятиями как свободная энергия поверхностного слоя жидкости и сила поверхностного натяжения. Свободная энергия поверхности:
где σ - поверхностное натяжение; s - суммарная поверхность двух фаз. Сила поверхностного натяжения - сила, действующая на единицу длины периметра взаимодействия двух фаз (линию смачивания): где L - линия смачиваемости. Коэффициент поверхностного натяжения с зависит от давления, температуры, газового фактора, свойств флюидов. Если поверхностное натяжение между двумя жидкостями, газом и жидкостью можно измерить, то на поверхности раздела породы-жидкости и породы-газа измерить трудно. Поэтому для изучения поверхностных явлений на границе порода-жидкость пользуются косвенными методами изучения поверхностных явлений: измерением работы адгезии и когезии, исследованием явлений смачиваемости и растекаемости, изучением теплоты смачивания. Смачиванием называется совокупность явлений на границе соприкосновения трёх фаз, одна из которых обычно является твёрдым телом и две другие - не смешиваемые жидкости или жидкость и газ. Капля жидкости может растекаться по поверхности, если поверхность хорошо смачивается, а если поверхность плохо смачивается, то капля растекаться не будет. Интенсивность смачивания характеризуется величиной краевого угла смачивания ϴ, образованного поверхностью твёрдого тела с касательной, проведённой к поверхности жидкости из точки её соприкосновения с поверхностью (рис. 5.1).
Краевой угол ϴ измеряется в сторону более полярной фазы (в данном случае в сторону воды). Принято условно обозначать цифрой 1 водную фазу, цифрой 2 -углеводородную жидкость или газ, цифрой 3 - твёрдое тело. Предполагая, что краевой угол ϴ отвечает термодинамическому равновесию, получим уравнение, впервые выведенное Юнгом:
откуда получим выражение для краевого угла ϴ:
Если σ 23 > σ 13, то 0< cosϴ < 1, из чего следует, что угол ϴ - острый (наступающий), а поверхность - гидрофильная. Если σ 23 > σ 13, то -1< cosϴ < 0, из чего следует, что угол ϴ - тупой (отступающий), а поверхность - гидрофобная. Существуют также переходные поверхности (т.н. амфотерные), которые хорошо смачиваются как полярными, так и неполярными системами. К гидрофильным поверхностям относятся силикаты, карбонаты, окислы железа. К гидрофобным поверхностям - парафины, жиры, воск, чистые металлы. Краевой угол смачивания зависит от строения поверхности, адсорбции жидкостей и газов, наличия ПАВ, температуры, давления, электрического заряда. Поверхностные явления описываются также работой адгезии. Адгезия - прилипание (сцепление поверхностей) разнородных тел. Когезия -явление сцепления поверхностей разнородных тел, обусловленной межмолекулярным или химическим взаимодействием. Работа адгезии оценивается уравнением Дюпре:
Используя соотношения (5.3) и (5.5), мы получим уравнение Дюпре-Юнга: Из соотношения:
следует, что при смачивании свободная энергия единицы поверхности твёрдого тела уменьшается на величину σ 12cosϴ, которую принято называть натяжением смачивания. Работа когезии WK характеризует энергетические изменения поверхностей раздела при взаимодействии частиц одной фазы. Из уравнения (5.6) следует, что на отрыв жидкости от поверхности твёрдого тела при полном смачивании (когда cosϴ =0) затрачивается работа, необходимая для образования двух жидких поверхностей:
поверхностное натяжение жидкости на границе с газом. Это значит, что при полном смачивании жидкость не отрывается от поверхности твёрдого тела, а происходит разрыв самой жидкости, т.е. при полном смачивании σ 12 < σ 13. Подставив в уравнение Юнга значения работ адгезии и когезии, получим Из этого уравнения следует, что смачиваемость жидкостью твёрдого тела тем лучше, чем меньше работа когезии (и поверхностное натяжение жидкости на границе с газом) Для характеристики смачивающих свойств жидкости используют также относительную работу адгезии z=Wa/WK. Ещё одна характеристика, используемая для описания поверхностных явлений - теплота смачивания. Установлено, что при смачивании твёрдого тела жидкостью наблюдается выделение тепла, так как разность полярностей на границе твёрдое тело-жидкость меньше, чем на границе с воздухом. Для пористых и порошкообразных тел теплота смачивания обычно имеет значение от 1 до 125 кДж/кг и зависит от степени дисперсности твёрдого тела и полярности жидкости. Теплота смачивания характеризует степень дисперсности твёрдого тела и природу его поверхности. Большее количество теплоты выделяется при смачивании той жидкостью, которая лучше смачивает твёрдую поверхность. Популярное:
|
Последнее изменение этой страницы: 2016-04-11; Просмотров: 735; Нарушение авторского права страницы