
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Карбонільні сполуки - АЛЬДЕГІДИ ТА КЕТОНИСтр 1 из 8Следующая ⇒
Карбонільні сполуки - АЛЬДЕГІДИ ТА КЕТОНИ Альдегідами і кетонами називають похідні вуглеводнів, у яких при одному атомі вуглецю два атоми водню заміщено киснем.
Якщо ж два атоми водню заміщено киснем при вторинному атомі вуглецю
У цьому випадку групу С=О називають кетогрупою. Альдегіди аліфатичного ряду бувають насиченими або ненасиченими. Насичені альдегіди та кетони НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ За номенклатурою IUPAC альдегіди називають за назвою відповідного вуглеводня з додаванням закінчення -аль. Кетони - з додаванням закінчення -он. Нумерація ланцюга в молекулах альдегідів починається з вуглецевого атома оксогрупи, а у кетонів - з того кінця ланцюга, до якого ближче розташована карбонільна група, при цьому положення оксогрупи вказують локантом. За радикало-функціональною номенклатурою кетони називають, вказуючи за алфавітним порядком вуглеводневі залишки, що зв'язані з карбонільною групою з додаванням суфіксу -кетон (табл.1). Тривіальні назви альдегідів походять, як правило, від назв кислот, в які вони перетворюються при окисненні (табл.1), з додаванням у кінці слова "альдегід".
Таблиця 1 Назви альдегідів і кетонів Структурна формула |
Номенклатура | |||||
|
Замісникова | Ра дикало-функціональна (тривіальна) | |||||
|
Альдегіди | ||||||

| Метаналь | (Мурашиний альдегід, формальдегід) | ||||
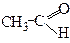
| Етаналь | (Оцтовий альдегід, ацетальдегід) | ||||

| Пропаналь | (Пропіоновий або пропіонатний альдегід) | ||||

| Бутаналь | (Масляний або бутиратний альдегід) | ||||
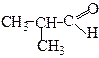
| 2-Метилпропаналь | (Ізомасляний або ізобутиратний альдегід) | ||||
|
Кетони | ||||||

| Пропанон | Диметилкетон (ацетон) | ||||

| Бутанон | Етилметилкетон | ||||

| 2-Пентанон | Метилпропілкетон | ||||

| 3-Метил-2-бутанон | Ізопропілметилкетон | ||||
Ізомерія альдегідів зв'язана з будовою вуглеводневого ланцюга, а кетонів ще й з положенням у ньому карбонільної групи.
СПОСОБИ ОДЕРЖАННЯ
Існує багато методів одержання альдегідів і кетонів.
Окиснення
Окис н ення алканів
Важливою промисловою реакцією є каталітичне окиснення метану до формальдегіду:
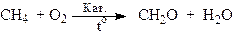
Вищі алкани також окиснюються киснем повітря з утворенням гідропероксидів, які, у свою чергу, розкладаються на спирти, альдегіди або кетони (див.стор. ).
2. Реакція оксосинтезу (гідроформілювання алкенів), О.Роєлен, 1938 р.
Алкени в присутності кобальтового каталізатора під тиском взаємодіють з синтез-газом з утворенням альдегідів:

Реакцію з етиленом і пропіленом проводять у газовій фазі, а з алкенами С4—С20 - у рідкій.
ФІЗИЧНІ ВЛАСТИВОСТІ
Насичені альдегіди та кетони - це безбарвні рідини. Метаналь - газ з різким запахом. Їх температури кипіння нижчі, ніж у спиртів, тому що для альдегідів і кетонів утворення водневого зв'язку не характерне. Кетони киплять при вищій температурі, ніж альдегіди.
ХІМІЧНІ ВЛАСТИВОСТІ
Хімічні властивості альдегідів і кетонів зумовлені наявністю в їх молекулах карбонільної групи. Атоми вуглецю та кисню мають різну електронегативність, тому зв'язок С=О сильно полярний. Завдяки цьому атоми вуглецю і кисню в карбонільній групі набувають значних ефективних зарядів.
| |


Енергія зв'язку дорівнює 733 467 кДж/моль (для порівняння, енергія С=С -зв'язку дорівнює 683 590 кДж/моль). Однак, завдяки високій полярності, реакційна здатність карбонільної групи значно вища, ніж С=С-зв'язку.
Вуглець карбонільної групи виявляє електрофільні властивості, а кисень - нуклеофільні. Завдяки цьому, атом вуглецю карбонільної групи здатний реагувати з нуклеофільними реагентами, а атом кисню з електрофільними. Замісники, які збільшують позитивний заряд на атомі вуглецю карбонільної групи (електроноакцептори), значно підвищують реакційну здатність альдегідів і кетонів. Протилежний ефект спостерігається при наявності електронодонорних замісників.
Головними типами хімічних реакцій альдегідів і кетонів є:
1) реакції приєднання за карбонільною групою;
2) реакції заміщення;
3) реакції окиснення;
4) реакції полімеризації та поліконденсації.
Приєднання спиртів

Напівацеталь у кислому середовищі може взаємодіяти ще з однією молекулою спирту з утворенням ацеталю.
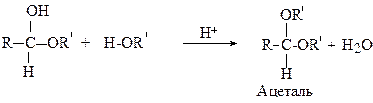
Ацеталі при нагріванні з розведеними кислотами піддаються гідролізу:

2.4. Приєднання води
Вода, як і спирти, є слабким нуклеофілом. Тому вона реагує тільки з дуже активними карбонільними сполуками (формальдегід, галогенозаміщені альдегіди та кетони):

Гідрат формальдегіду
Приєднання аміаку
Ця реакція дозволяє розрізняти альдегіди і кетони. Альдегіди приєднують аміак з утворенням гідроксиамінів. Дана реакція практично завжди закінчується відщепленням води і утворенням зв'язку C=N. Одержані сполуки називають альдімінами.

Часто вона супроводжується полімеризацією альдімінів у циклічні сполуки (альдегідаміаки):
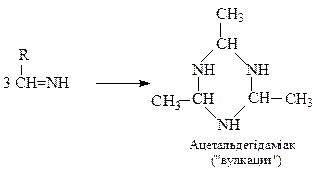
Вулкацит застосовується як прискорювач вулканізаціє каучуків.
Кетони з аміаком реагують складніше і значно повільніше. Спочатку у присутності аміаку кетон димеризується з відщепленням води, а потім приєднує аміак не за карбонільною групою, а за подвійним С=С-зв‘язком.
 4-Метил-4-аміно-2-пентанон
4-Метил-4-аміно-2-пентанон
(Диметилацетонілметиламін)
2.6. Взаємодія з гідроксиламіном ( NH 2 OH )
Дана реакція застосовується для кількісного визначення альдегідів і кетонів. При цьому утворюються альдоксими і кетоксими:


Реакції заміщення (S)
Атоми гідрогену біля α-вуглецевого атому характеризуються підвищеною рухливістю і можуть легко обмінюватися на інші атоми чи функціональні групи.
Ці реакції протікають за механізмом електрофільного заміщення (SЕ):

2-Хлоропропаналь
Реакції такого типу протікають через стадію утворення енолу, чому сприяють кислоти або основи:

Реакції окиснення
При окисненні альдегідів утворюються відповідні кислоти:

Оцтовий альдегід Оцтова (ацетатна) кислота
Окиснення аміачним розчином оксиду срібла (реактивом Толенса) називається "реакцією срібного дзеркала" і може служити якісною реакцією на альдегідну групу:
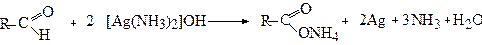
Кетони в “реакцію срібного дзеркала” не вступають.
Окиснення кетонів відбувається складніше і протікає лише в жорстких умовах. При їх окисненні спостерігається розрив вуглецевого ланцюга:

Суміш карбонових кислот
Полімеризація формальдегіду
У присутності певних каталізаторів формальдегід здатний до полімеризації за рахунок розкриття π-зв'язку карбонільної групи (аналогічно до полімеризації алкенів):
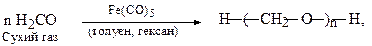
При цьому утворюється лінійний високомолекулярний поліформальдегід, який застосовується для виробництва синтетичного волокна. Внаслідок наявності кінцевих НО-груп при нагріванні >100oC протікає деполімерізація поліформальдегіду (руйнування ланцюга). Тому для підвищення стабільності його кінцеві гідроксильні групи ацилюють оцтовим ангідридом, що дозволяє підвищити стійкість полімеру до 250оС у відсутності кисню.
 У випадку протікання ступінчастої полімеризації у водних розчинах, в залежності від умов, утворюється α-поліоксиметилен або параформальдегід (параформ):
У випадку протікання ступінчастої полімеризації у водних розчинах, в залежності від умов, утворюється α-поліоксиметилен або параформальдегід (параформ):

(40%-ний водний Метиленгліколь
розчин формальдегіду
(формалін)

п= 8 - 100 (параформ),
1000>n>100 ( α-поліоксиметилен)
α-Поліоксиметилен і параформ легко деполімеризуються, що й використовують для добування формальдегіду в газоподібному стані.
Формальдегід схильний також вступати у реакції циклічної полімеризації в присутності кислот:
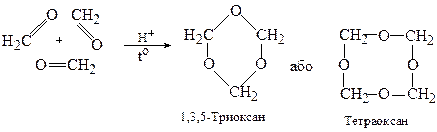
У випадку оцтового альдегіду утворюється циклічний тример:

2,4,6-Триметил-1,3,5-триоксан
(паральдегід)
Циклічні тримери, в залежності від умов, здатні до реакцій деполімеризації або полімеризації.
Кротонова конденсація
Якщо утворений в результаті альдольної конденсації альдоль містить в α-положенні атоми водню, то при нагрівання він може відщеплювати воду з утворенням ненасиченого альдегіду. Таке продовження реакції альдольної конденсації називається кротоновою конденсацією, за назвою альдегіду, вперше одержаного таким шляхом.
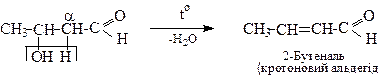 )
)
Альдольна і кротонова конденсація кетонів відбуваються у жорсткіших умовах, ніж альдегідів.
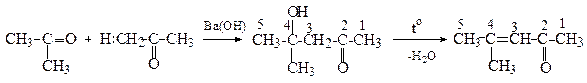 4-Метил-4-гідрокси-2-пентанон 4-Метил-3-пентен-2-он
4-Метил-4-гідрокси-2-пентанон 4-Метил-3-пентен-2-он
(Оксид мезитилу)
2.3. Есте рна конденсація (В.Є.Тищенко, 1906)
У присутності алкоголяту алюмінію відбувається диспропорціювання альдегідів, тобто одна молекула альдегіду відновлюється, а друга окиснюється за рахунок переносу гідрид-йона, з утворенням естеру:

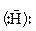 Механізм естерної конденсації. Взаємодія атома алюмінію з атомом кисню значно збільшує електрофільність сусіднього вуглецю. Це сприяє протіканню конденсації та перенесенню гідрид-іона
Механізм естерної конденсації. Взаємодія атома алюмінію з атомом кисню значно збільшує електрофільність сусіднього вуглецю. Це сприяє протіканню конденсації та перенесенню гідрид-іона

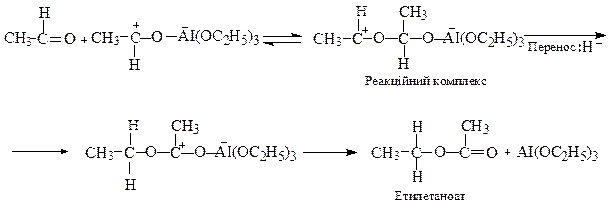
Окремі представники
Метаналь (мурашиний альдегід, формальдегід) – безбарвний газ з різким специфічним запахом. Дуже отруйний. Здатний вступати в реакції конденсації з утворенням синтетичних смол, які широко застосовуються у промисловості. Метаналь використовується для дезинфекції зерно- і овочесховищ, парників, теплиць, для протравлення зерна, задублення шкір та ін.
Етаналь (оцтовий альдегід, ацетальдегід) – рідина з різким неприємним запахом. У промислових масштабах з нього одержують оцтову кислоту, етиловий спирт, альдоль, бутиловий спирт, ацеталі, та цілий ряд інших речовин.
Ацетон – безбарвна речовина з характерним запахом. Добре розчинний у воді і в багатьох органічних розчинниках. В якості розчинника ацетон використовують в дуже великій кількості у лакофарбній промисловості, у виробництві ацетатного шовку, кіноплівки та ін. Він служить вихідним продуктом у виробництві органічного скла,
кетену тощо.
Структурна формула
Номенклатура
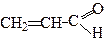
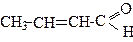
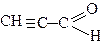
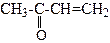

Акроле ї н (2-пропеналь) одержують кротоновою конденсацією суміші метаналю та етеналю через стадію альдолю:
 3-Гідроксипропаналь Пропеналь
3-Гідроксипропаналь Пропеналь
(акролеїн)
Крім того його отримують окисненням пропену молекулярним киснем без каталізатора. При цьому утворюється гідропероксид, який далі розпадається на спирт та альдегід:

Ще один спосіб ― дегідратація гліцеролу (див.стор. ).
Кротоновий альдегід (2-бутеналь). Кротоновий альдегід отримують реакцією кротонової конденсації оцтового альдегіду (див.стор.) .
Вінілметилкетон (3-бутен-2 - он). Вінілметилкетон отримують за реакцією Кучерова з вініацетилену:

або кротоновою конденсацією формальдегіду з ацетоном через альдоль:
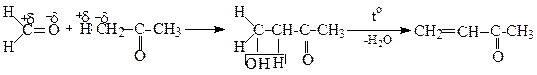
Альдоль
 Хімічні властивості ненасичених альдегідів і кетонів залежать від взаємного розташування і впливу один на одного карбонільної групи і кратних зв'язків. У випадку спряження зв'язків С=С і С=О їм притаманні специфічні властивості. Так, за рахунок значних (-І) і (-М)-ефектів, що проявляє карбонільна група, подвійний С=С-зв'язок сильно поляризується. Тому, приєднання галогеноводнів відбувається проти правила Марковнікова:
Хімічні властивості ненасичених альдегідів і кетонів залежать від взаємного розташування і впливу один на одного карбонільної групи і кратних зв'язків. У випадку спряження зв'язків С=С і С=О їм притаманні специфічні властивості. Так, за рахунок значних (-І) і (-М)-ефектів, що проявляє карбонільна група, подвійний С=С-зв'язок сильно поляризується. Тому, приєднання галогеноводнів відбувається проти правила Марковнікова:

Енольна форма Кетонна форма
альдегіду альдегіду
(3-бромопропаналь)
Приєднання HCN (цианідної кислоти) відбувається тільки за участю С=О групи:

Ціангідрин
Приєднання натрій гідросульфіту ( NaHSO 3 ) відбувається як за карбонільною групою, так і за подвійним зв'зком:
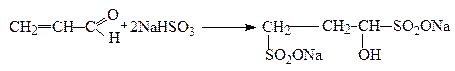
Кетени
Кетенами називаються сполуки з системою кумульованих зв'язків, подібних до алкадієнів типу алену.
Кетен (Н2С = С = О) отримують піролізом ацетону:

 Кетени характеризуються значним позитивним зарядом на карбонільному атомі вуглецю, що перебуває в sp-гібридному стані. Тому вони проявляють високу реакційну здатність і реагують з водою, спиртами, кислотами (нуклеофільними сполуками)
Кетени характеризуються значним позитивним зарядом на карбонільному атомі вуглецю, що перебуває в sp-гібридному стані. Тому вони проявляють високу реакційну здатність і реагують з водою, спиртами, кислотами (нуклеофільними сполуками)



МЕТОДИ ОДЕРЖАННЯ
1. Окиснення алкілароматичних вуглеводнів (алкіларенів або діарилметанів):

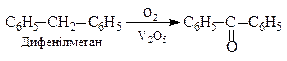
Реакції конденсації
1.1. Перехресна альдольна та кроонова конденсація. Аренкабальдегіди типу бензойного та діарилкетони типу дифенілкетона не вступають в альдольну конденсацію, оскільки в α-положенні відносно карбонільної С=О групи нема атомів водню. Однак, з карбонільними аліфатичними сполуками вступають в пререхресну альдольну і далі кротонову конденсацію (конденсація Л.Кляйзена) з утворенням ненасичених алкілароматичних альдегідів:
 Цинамоновий альдегід
Цинамоновий альдегід

Реакція У.Перкіна (1868)
Аналогічно до кротонової конденсації протікає конденсація ароматичних альдегідів з ангідридами аліфатичних кислот. Каталізаторами цієї реакції служать калієві або натрієві солі відповідних кислот, які за рахунок гідролізу створюють лужне середовище.

транс-3-Фенілпропенова кислота (цинамонатна кислота)
Реакції окиснення
Аренкарбальдегіди легко окиснюються на повітрі. Для аліфатичних альдегідів це не характерно

Процес окиснення протікає за радикальним механізмом з утворенням проміжних гідропероксидів
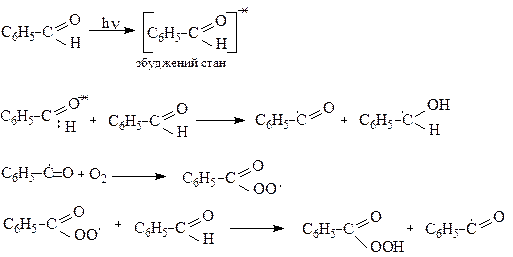

Окремі представники
Бензенкарбальдегід - одержують у промисловості окисненням толуєну або гідролізом бензиліденхлориду. Застосовують у виробництві барвників, запашних речовин.
Ацетофенон - одержують ацетилюванням бензену або окисненням етилбензену. Застосовують у парфюмерії.

Саліциловий альдегід отримують з фенолу і хлороформу реакцією Ф.Тімана-К.Реймера (1875).

о-Гідроксибензальдегід
(саліциловий альдегід)
Застосовують в аналітичній хімії та в органічному синтезі.
Кетон Мі х лера (п,п΄,N,N΄-тетраметилдіамінодифенілкетон) одержують шляхом аци-лювання фосгеном диметиланіліну. Застосовується у виробництві барвників

Кетон Міхлера
ХІНОНИ
Хінони - це циклічні карбонільні сполуки, в яких відсутній ароматичний характер, але вони легко одержуються з ароматичних сполук. Хінони мають будову ненасичених циклічних дикетонів. Хінони розрізняються в залежності від числа циклів у молекулі

п-Бензохінон або о-Бензохінон Тетрахлоро-1,4-бензохінон
1,4-Бензохінон (о-хінон) (хлораніл)
(п-хінон)
Одержують хінони окисненням двоатомних фенолів, аренамінів або, фенілен-діамінів.

Гідрохінон п-Бензохінон
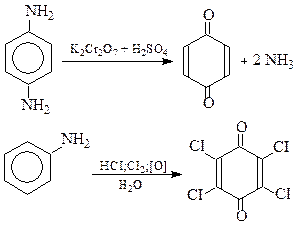
Хлораніл
ХІМІЧНІ ВЛАСТИВОСТІ
Для хінонів характерні деякі реакції кетонів
Відновлення хінонів

Реакція відновлення протікає швидко і кількісно при електролізі водних розчинів хінонів, на катоді або під дією сильного відновника, через стадію утворення аніон-радикала (семіхінону).
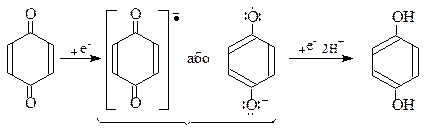 Аніон-радикал
Аніон-радикал
(семіхінону)
Реакції дієнового синтезу
Хінони є дієнофілами і вступають у реакції дієнового синтезу.
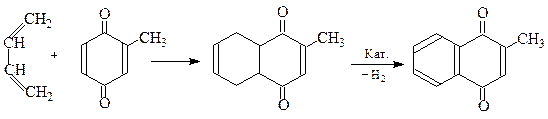
Толухінон Тетрагідрометинон 2-Метил-1,4-нафтохінон
-(метинон або вітамін К3)
Окремі представники
п-Бензохінон одержують окисненням аніліну. Застосовується для одержання гідрохінону та в органічному синтезі.
Хлораніл застосовується у виробництві барвників та гуми.
Дикарбонільні сполуки
Сполуки, що містять дві карбонільні групи називаються діальдегідами і дикетонами.
Діальдегіди:
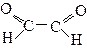
Етандіаль, гліоксаль (α-діальдегід)

Пропандіаль, малоновий альдегід ( β-діальдегід)
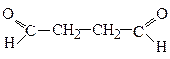
Бутандіаль, бурштиновий альдегід
Дикетони:

2,3-Бутандіон, діацетил ( α-дикетон)
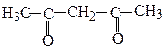
2,4-Пентандіон, ацетилацетон ( β-дикетон)
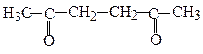 2,5-Гександіон, ацетонілацетон
2,5-Гександіон, ацетонілацетон
Існують змішані дикарбонільні сполуки (альдегідокетони), наприклад:
 3-Оксобутаналь, формілацетон.
3-Оксобутаналь, формілацетон.
Гліоксаль одержують м'яким окисненням етиленгліколю або оцтового альдегіду:

Гліоксаль виявляє всі властивості альдегідів:

Монооксим Діоксим гліоксалю
гліоксалю (гліоксим)
Діацетил одержують з метилетилкетону:

Монооксим Діацетил або
дикетону бутандіон
α-Дикетони маіють підвищену реакційну здатність, вони легко утворюють діоксими:

Діоксим бутандіону або
диметилгліоксим
(реактив Чугаєва)
Диметилгліоксим застосовується як реактив на іони Ni2+ з якими він утворює комплексну сполуку хелат - яскраво-червоного кольору:
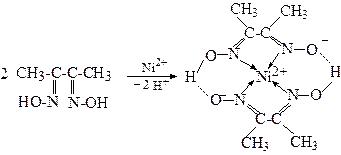
Ацетилацетон отримують конденсацією Кляйзена з етилацетату і ацетону:

Ацетилацетон є прикладом сполуки, що утворює доволі стабільну енольну форму, тому він схильний до кето-енольної таутомерії:
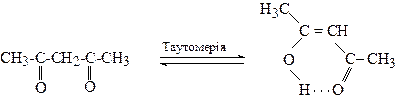
Кетонна форма 15% Енольна форма 85%
Карбонільні сполуки - АЛЬДЕГІДИ ТА КЕТОНИ
Альдегідами і кетонами називають похідні вуглеводнів, у яких при одному атомі вуглецю два атоми водню заміщено киснем.
 Сполуки, в яких на кисень заміщено водні при первинному атомі вуглецю , називаються альдегідами:
Сполуки, в яких на кисень заміщено водні при первинному атомі вуглецю , називаються альдегідами:
Якщо ж два атоми водню заміщено киснем при вторинному атомі вуглецю 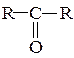 , то такі оксосполуки називаються кетонами:
, то такі оксосполуки називаються кетонами:
У цьому випадку групу С=О називають кетогрупою.
Альдегіди аліфатичного ряду бувають насиченими або ненасиченими.
Последнее изменение этой страницы: 2019-05-07; Просмотров: 178; Нарушение авторского права страницы