
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Карбоновые кислоты и их производные. Реакции нуклеофильного замещения
Функциональная группа карбоновых кислот слагается из двух составляющих - карбонильной и гидроксильной, формирующих качественно новую – карбоксильную группу:
В зависимости от радикала, связанного с карбоксильной группой, кислоты могут быть предельными и непредельными, относиться к ациклическому, циклическому, ароматическому и гетероциклическому ряду. Число карбоксильных групп в молекуле определяет основность кислот. Общая формула карбоновых кислот:
Простейшая карбоновая кислота – муравьиная (метановая) – не содержит радикала.
Содержится в выделениях муравьев, соке крапивы, хвое, фруктах. В пищевой промышленности используется для дезинфекции бродильных чанов и бочек.
Уксусная кислота (этановая) – составляет примерно 85% всех органических кислот в зерне пшеницы и кукурузы. Для получения «пищевой» уксусной кислоты используют брожение водных растворов этанола (под действием уксуснокислых бактерий). Её выделяют также из продуктов брожения виноградного и фруктового соков. Уксусную кислоту используют в качестве консервирующего средства при производстве маринадов и как вкусовую добавку.
Пропионовая кислота (пропановая):
Масляная кислота (бутановая):
Валериановая кислота (пентановая)
Капроновая кислота (гексановая):
Пальмитиновая кислота (гексадекановая):
Стеариновая кислота (октадекановая):
Пальмитиновая и стеариновая кислоты входят в состав жиров животного происхождения. В состав растительных масел входят, в основном, ненасыщенные жирные кислоты: олеиновая:
Олеиновая кислота в масле арахиса составляет 50 – 80%, в оливковом масле 70 – 85%. Линолевая кислота:
В льняном масле составляет примерно 30 – 50%
Линоленовая кислота:
Среди ароматических карбоновых кислот наибольшее значение имеет бензойная кислота:
Она используется в качестве консерванта, содержится в клюкве, бруснике, рябине, поэтому они способны к длительному хранению.
Из двухосновных карбоновых кислот чаще всего встречаются щавелевая, малоновая, адипиновая, фумаровая кислоты:
Щавелевая кислота:
Содержится в растениях в виде соли кальция, нарпимер, в щавеле.
Малоновая кислота:
Содержится в свекловичном соке.
Адипиновая кислота:
Используется в пищевой промышленности как заменитель лимонной кислоты
Фумаровая кислота:
Содержится в мясе и грибах.
Способы получения:
1. Окисление первичных спиртов и альдегидов.
2. Гидролиз сложных эфиров и жиров
3. Гидролиз нитрилов
Физические свойства: Низшие предельные одноосновные карбоновые кислоты – подвижные жидкости с резким, острым запахом, хорошо растворимые в воде, спирте, эфире, бензоле и других растворителях. Кислоты с количеством атомов углерода от 4 до 9 – маслянистые жидкости с неприятным запахом. Высшие карбоновые кислоты – твердые, без запаха, нерастворимые в воде. Карбоновые кислоты имеют температуры кипения более высокие, чем спирты с тем же количеством атомов углерода. Это обусловлено их более высокой молекулярной массой, а также водородными связями, приводящими к ассоциации молекул.
Низкомолекулярные карбоновые кислоты объединяются водородными связями в прочные димеры:
Димеры могут, не разрушаясь, сохраняться в паровой фазе.
Химические свойства: Нуклеофильное замещение Характерно для карбоновых кислот и их функциональных производных. Механизм:
Реакция этерификации:
Задание 10 Напишите уравнение реакции этерификации стеариновой кислоты этанолом с указанием механизма и реакционного центра в субстрате.
Образец выполнения:
Задание №10 контрольная работа. Напишите уравнение реакции этерификации (с указанием механизма и реакционного центра в субстрате): Вариант 1 уксусной кислоты бутанолом -2
Вариант 2 пальмитиновой кислоты метанолом
Вариант 3 бензойной кислоты пропанолом – 1
Вариант 4 олеиновой кислоты пентанолом – 3
Вариант 5 пропановой кислоты пропанолом - 2
Моносахариды
Углеводы Углеводы – обширный класс природных соединений, которые играют важную роль в жизни человека, животных и растений. Название «углеводы» эти соединения получили потому, что состав многих из них выражается общей формулой Сn(H2O)m, т.е. они формально являются соединениями углерода и воды. С развитием химии углеводов обнаружены соединения, состав которых не отвечает приведенной общей формуле, но обладающих свойствами веществ своего класса (например, дезоксирибоза С5Н10О4). В то же время есть вещества, соответствующие обще формуле углеводов, но не проявляющие их свойств (например, природный шестиатомный спирт инозит С6Н12О6).
Биологическая роль
Хролофилл, hv
Углеводы
Животные не способны сами синтезировать углеводы и используют углеводы, синтезируемые растениями. Углеводы составляют значительную долю пищи млекопитающих. В процессе дыхания происходит окисление углеводов, в результате чего выделяется энергия, необходимая для функционирования живых организмов:
При полном окислении 1 г углеводов освобождается 17, 6 кДж энергии. Некоторое количество выделяющейся энергии превращается в тепло, а бо́ льшая часть ее аккумулируется в АТФ (см. тему «Нуклеиновые кислоты») и затем расходуется в процессах жизнедеятельности. Функции углеводов в живых организмах разнообразны. Они служат источником запасной энергии (в растениях – крахмал, в животных организмах – гликоген). В растительных организмах углеводы являются основой клеточных мембран. В качестве одного из структурных компонентов остатки углеводов входят в состав нуклеиновых кислот.
Классификация углеводов Все углеводы можно разделить на две группы: простые углеводы, или моносахариды и сложные углеводы. Простые углеводы (моносахариды) – это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов. С ложные углеводы – это углеводы, молекулы которых состоят из двух или большего числа остатков моносахаридов и разлагаются на эти моносахариды при гидролизе.
Моносахариды Моносахариды представляют собой соединения со смешанными функциями. Они содержат альдегидную или кетогруппу и несколько гидроксильных групп, т.е. являются альдегидоспиртами или кетоноспиртами. Следовательно, углеводы являются полигидроксикарбонильными соединениями. Моносахариды с альдегидной группой называются альдозами, с кетогруппой – кетозами. По числу углеродных атомов в молекуле моносахариды делятся на тетрозы, пентозы, гексозы и т.д.
Структура моносахаридов Для изображения строения моносахаридов используют проекционные формулы Фишера. В формулах Фишера цепь углеродных атомов располагается в одну линию. Нумерация цепи начинается с атома углерода альдегидной группы (в случае альдоз) или с крайнего атома углерода, к которому ближе располагается кетогруппа (в случае кетоз). Атомы водорода и группы –ОН у асимметрических атомов «С» располагаются слева и справа от углеродной цепи. В зависимости от пространственного расположения атомов «Н» и ОН-групп у 4-го атома углерода у пентоз и 5-го атома углерода у гексоз моносахариды относят к D- или L-ряду. Моносахарид относят к D-ряду, если ОН-группа у этих атомов располагается справа от цепи:
Рассмотренные выше структуры моносахаридов являются ациклическими. Однако моносахариды могут существовать также в циклических формах. Циклические формы образуются в результате взаимодействия карбонильной группы и одной из гидроксильных групп с образованием внутренних полуацеталей. Альдегидная или кетонная группа гексоз и пентоз взаимодействует с гидроксильными группами у С-4 или С-5. В результате образуются пяти- или шестичленные циклы. Эти циклы структурно аналогичны кислородосодержащим гетероциклам пирану и фурану:

Поэтому циклические формы гексоз и пентоз соответственно называются пиранозными и фуранозными.
 
В растворах моносахаридов происходит миграция протона между гидроксо- и карбонильной группой, при этом устанавливается подвижное равновесие между ациклической и циклической формами. Подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами) называется таутомерией. Циклические формы принято изображать перспективными формулами Хеуо́ рса. Для перехода от формул Фишера к формулам Хеуорса нужно знать следующие правила: 1. Изображаем цикл в виде плоского многоугольника (при этом цикл находится в плоскости, перпендикулярной плоскости изображения). Нумерацию атомов углерода в цикле производим по часовой стрелке. (Символы атомов углерода обычно не записываются). 2. Атомы и группы атомов, которые в формуле Фишера находятся справа от цепи, в формуле Хеуорса располагаются под плоскостью цикла, и наоборот. Исключение составляет группа -СН2ОН у 5-го атома углерода в гексозах, которая в случае D-гексоз всегда располагается над плоскостью цикла.
В циклических формах моносахаридов появляется еще один асимметрический атом углерода (С-1 у альдоз и С-2 у кетоз). Этот асимметрический атом углерода называется аномерным. Изомеры углеводов, отличающиеся расположением атомов и атомных групп у аномерного атома углерода, называются аномерами. Стереоизомер (пространственный изомер), в котором группа –ОН у аномерного атома «С» располагается под плоскостью цикла, называется α -аномером, а стереоизомер с противоположным расположением ОН-группы называется β -аномером:
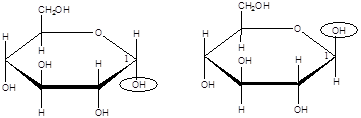
Аномеры не могут непосредственно превращаться друг в друга. Переход от одного аномера к другому возможен только через промежуточное образование ациклической формы моносахарида. Таким образом, в растворе глюкозы присутствуют различные таутомерные формы, находящиеся в динамическом равновесии:

Среди пентоз наиболее известны D-рибоза, у которой нет гидроксильной группы при втором углеродном атоме. Эти моносахариды входят в состав рибо- и дезоксирибонуклеиновых кислот (РНК и ДНК) в фуранозной форме.


Физические свойства Моносахариды представляют собой бесцветные кристаллические вещества, сладкие на вкус, хорошо растворимые в воде, нерастворимые в эфире, плохо растворимые в спирте. Сладость моносахаридов различна. Например, фруктоза слаще глюкозы в три раза.
Химические свойства Моносахариды – это соединения со смешанными функциями. В растворах существует динамическое равновесие между несколькими таутомерными формами моносахаридов, поэтому в зависимости от условий и реагентов они могут реагировать в открытой или циклической форме. При этом равновесие смещается в сторону образования той формы, которая вступает во взаимодействие. Химические свойства моносахаридов обусловлены наличием: а) карбонильной группы в открытых формах моносахаридов; б)спиртовых гидроксильных групп как в открытых, так и в циклических формах моносахаридов; в) полуацетальной гидроксильной группы в циклических формах моносахаридов. Рассмотрим химические свойства моносахаридов на примере важнейшего из них – глюкозы.
I. Реакции с участием альдегидной группы глюкозы, т.е. свойства глюкозы как альдегида.
1. Восстановление (гидрирование) с образованием многоатомного спирта:

О
В ходе этой реакции карбонильная группа –С– восстанавливается и образуется новая спиртовая группа – ОН. 2. Окисление Глюкоза легко окисляется. В зависимости от характера окислителей получаются различные продукты.
1) Окисление под действием слабых (мягких) окислителей с образованием глюконовой кислоты. К числу таких реакций относятся качественные реакции на глюкозу как альдегид: реакции с аммиачным раствором оксида серебра (I) Ag2O (реакция «серебряного зеркала») и реакция с гидроксидом меди (II) Cu(OH)2 в щелочной среде при нагревании:

В ходе этих реакций альдегидная группа
2) Окисление под действием сильных окислителей (например, азотной кислоты HNO3) c образованием двухосновной глюкаровой кислоты:

В ходе этой реакции и альдегидная группа
II. Реакции глюкозы с участием гидроксильных групп (т.е. свойства глюкозы как многоатомного спирта).
1. Взаимодействие с Cu(OH)2 на холоду с образованием глюконата меди (II) (качественная реакция на глюкозу как многоатомный спирт):
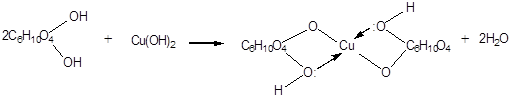
2. Взаимодействие с ангидридами или галогенангидридами кислот с образованием сложных эфиров:

3. Взаимодействие с галогеналканами с образованием простых эфиров:

Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции HI. 4. Взаимодействие со спиртами с образованием гликозидов.
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения. В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
 
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют. Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы связаны остатки самых различных соединений. III. Брожение (ферментация) моносахаридов Брожение – это расщепление моносахаридов под влиянием биологических катализаторов – ферментов, вырабатываемых микроорганизмами. Разные микроорганизмы вызывают различные виды брожения. Название вида брожения определяется названием образующихся продуктов брожения. Брожение – сложный многостадийный биохимический процесс. Ниже приводятся лишь суммарные уравнения различных типов брожения глюкозы.
1. Спиртовое брожение:
2.
3. Молочнокислое брожение:
ОН Популярное:
|
Последнее изменение этой страницы: 2016-03-16; Просмотров: 2664; Нарушение авторского права страницы