
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Различие в строении и свойствах крахмала и целлюлозы
1. Содержат остатки разных форм циклической глюкозы: крахмал – остатки α -глюкозы; целлюлоза – остатки β -глюкозы. 2. Содержат разное число структурных звеньев – остатков глюкозы: крахмал – до нескольких тысяч (Мr до 1 млн.); целлюлоза – до 40 тысяч (Мr до 20 млн.). 3. Между остатками глюкозы образуются различные связи: в крахмале – α -1, 4 и α -1, 6-гликозидные связи; в целлюлозе – β -1, 4-гликозидные связи. 4. Макромолекулы имеют различную структуру: крахмал – разветвленные и неразветвленные молекулы, компактно свернутые; целлюлоза – только неразветвленные молекулы, имеют вид нитей, так как форма остатков β -глюкозы исключает спирализацию. 5. Характер межмолекулярных взаимодействий: в крахмале макромолекулы имеют компактную форму, водородные связи между ними почти не образуются; в целлюлозе между молекулами нитевидной формы образуются очень прочные водородные связи (в которых участвуют свободные гидроксильные группы), нити объединяются в пучки, пучки – в волокна. Поэтому в воде, спирте, эфире целлюлоза не растворяется и не набухает, как крахмал. 6. Крахмал – продукт питания, так как в организмах человека и животных есть ферменты, расщепляющие α -1, 4 и α -1, 6-гликозидные связи. Целлюлоза не является продуктом питания человека и большинства животных, так как в их организмах нет ферментов, расщепляющих более прочные β -1, 4-гликозидные связи. Жвачные животные и кролики способны усваивать целлюлозу при посредстве содержащихся в их организме бактерий.
Химические свойства целлюлозы 1. Гидролиз целлюлозы При длительном нагревании с минеральными кислотами или под действием ферментов (у жвачных животных) идет ступенчатый гидролиз целлюлозы.

 
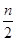 С12Н22О11 nС6Н12О6 С12Н22О11 nС6Н12О6
2. Образование сложных эфиров Каждое структурное звено целлюлозы содержит три свободных гидроксила:
Следовательно, целлюлоза может вступать в реакции, характерные для многоатомных спиртов:
а) взаимодействие с неорганическими кислотами:

б) взаимодействие с органическими кислотами:
3. Горение – полное окисление:

4.
 (С6Н10О5)n Древесный уголь + Н2О + Летучие органические вещества (С6Н10О5)n Древесный уголь + Н2О + Летучие органические вещества
Применение целлюлозы Являясь составной частью древесины, целлюлоза используется в строительном и столярном деле и как топливо (горение идет с выделением энергии); из древесины получают бумагу и картон, этиловый спирт. В виде волокнистых материалов (хлопка, льна, конопли) целлюлоза используется для изготовления тканей, нитей; эфиры целлюлозы идут на изготовление нитролаков, кинопленок, бездымного пороха, пластмасс, медицинского коллодия, искусственного волокна.
Задание № 12 Написать структурную формулу соединения, охарактеризовать моносахаридный состав и тип химической связи.
Образец выполнения:
Задания № 12 контрольной работы Написать структурную формулу соединения, охарактеризовать моносахаридный состав и тип химической связи
Вариант 1 целлюлозы Вариант 2 лактозы Вариант 3 мальтозы Вариант 4 крахмала Вариант 5 целлобиозы A-Аминокислоты, пептиды, белки Аминокислоты, пептиды, белки · Аминокислоты – это производные углеводородов, содержащие аминогруппы (-NH2) и карбоксильные группы
Классификация 1. По числу функциональных групп:
2. По положению аминогруппы:
Остатки около 20 различных α -аминокислот входят в состав белков (табл. 1). Таблица 1 Формулы и названия некоторых α -аминокислот, остатки которых Входят в состав белков
Аминокислоты организма
Физические свойства Аминокислоты - бесцветные кристаллические вещества, хорошо растворяются в воде, температура плавления 230о-300о. Многие α -аминокислоты имеют сладкий вкус.
Химические свойства
Основные свойства Кислотные свойства (свойства аминов) (свойства карбоновых кислот)
Амфотерные свойства
1. Взаимодействие с основаниями и с кислотами: а) как кислота (участвует карбонильная группа):
Глицин Глицинат натрия (соль)
б) как основание (участвует аминогруппа):
Глицин Солянокислый глицин (соль)
2. Взаимодействие внутри молекулы – образование биполярных ионов:
Внутренняя соль (биполярный ион, или цвиттер-ион)
3. Взаимодействие аминокислот друг с другом – образование пептидов.
 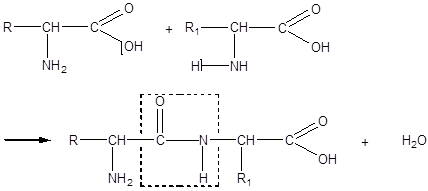
Пептидная группа (амидная связь)
Две аминокислоты образуют дипептид:

Глицилаланин
Любой дипептид имеет свободные амино- и карбоксильную группы и поэтому может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид; таким же путем получаются тетрапептиды и т.д.:
Способы получения 1. из a-галогенкарбоновых кислот
2. гидролиз белков При гидролизе белков образуется около 25 аминокислот. Смесь аминокислот разделяют с помощью хроматографии. 3. Микробиологический способ Так как для некоторых a-аминокислот существуют трудности как химического синтеза, так и хроматографического разделения их оптических изомеров, их получают с помощью микроорганизмов. Пептиды
Олигопептиды Полипептиды (содержат до десяти аминокислот- (содержат более десяти амино- ных остатков) кислотных остатков)
Некоторые аминокислоты нормального строения применяются для получения синтетических полипептидов (полиамидных волокон). При поликонденсации α -аминокапроновой кислоты получается полимер капрон:
Структурное звено Из капроновой смолы получают не только волокно, но и пластмассовые изделия.
· Белки – это высокомолекулярные соединения (биополимеры), структурную основу которых составляют полипептидные цепи, построенные из остатков α -аминокислот. Белки
Протеины Протеиды (простые белки) (сложные белки)
Все белки являются полипептидами, но не всякий полипептид является белком. Каждый белок имеет свое специфическое (индивидуальное и постоянное) строение.
Строение белковых молекул Различают четыре уровня структурной организации белковых молекул. Первичная структура белка – это число и последовательность аминокислотных остатков в полипептидной цепи. (Полипептидную теорию строения белков предложил немецкий химик Э.Шифер в начале ХХ в.). В организме человека свыше 10000 различных белков, и все они построены из одних и тех же 20 α -аминокислот (формулы некоторых из них приведены в табл. 1), которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 105. Потенциально возможное число белков с различной первичной структурой практически не ограничено. Фрагмент полипептидной цепи:
Пептидная группа Аминокислотный остаток – структурное звено полипептида R1, R2, R3, R4 – радикалы α -аминокислот. Один из первых белков, первичная структура которого была установлена в 1954 г., - гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30), Мг(инсулина) Другой белок – фермент рибонуклеаза – состоит из 124 аминокислотных остатков и имеет Мг Белок крови – гемоглобин имеет Мг Белки некоторых вирусов имеют Мг до 50 млн. Относительная молекулярная масса белков изменяется в широких пределах: от 5 тыс. до десятков миллионов. Вторичная структура белка (для большинства белков) – это α -спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами: Теоретически все –С– и –N– группы могут участвовать в образовании
О Н водородных связей, поэтому вторичная структура очень стабильна. В одном витке спирали обычно содержится 3, 6 аминокислотного остатка. Вторичная структура была установлена американским химиком Л. Полингом в 1951 г. Существуют белки, имеющие другие типы вторичной структуры.

Третичная структура белка – пространственная конфигурация спирали. У большинства белков полипептидные цели свернуты особым образом в «клубок» - компактную «глобулу» (рис. 2). Эта структура поддерживается за счет гидрофобных взаимодействий, а также водородных, дисульфидных, ионных и других связей.
Рис. 2. Третичная структура белковой молекулы («глобула»). В количественном отношении наиболее важны гидрофобные (от греч. «гидро» - вода, «фобос» - страх) взаимодействия. Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу. В результате взаимодействия между различными функциональными группами полипептидной цепи образуются: дисульфидные мостики (-S-S-), в создании которых участвуют атомы серы серусодержащих аминокислот (например, цистеина); солевые мостики (NH3+COO-) – получаются при взаимодействии карбоксильных и аминогрупп (ионная связь); сложноэфирные мостики
- результат взаимодействия карбоксильных и гидроксильных групп. Существуют белки, у которых третичная структура почти или совсем не выражена. Четвертичная структура белка – способ совместной укладки нескольких полипептидных цепей; образующиеся структуры называются ассоциатами. Например, гемоглобин (белок крови) – это сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет. В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
Рис. 3. Четвертичная структура белка (ассоциат, образованный четырьмя полипептидными цепями). Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Физические свойства Свойства белков так же разнообразны, как и функции, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Химические свойства В радикалах аминокислотных остатков белки содержат различные функциональные группы, которые способны вступать во многие реакции. Белки вступают в реакции окисления-восстановления, этерификации, алкирования, нитрования, могут образовывать соли как с кислотами, так и с основаниями (белки амфотерны).
 α -аминокислоты α -аминокислоты
2. Осаждение белков:
в растворе белка
в растворе вторичной и третич- ной структурой
Например, альбумин – яичный белок – при температуре 60-70о осаждается из раствора (свертывается), теряя способность растворяться в воде.
 
Рис. 4. Схема процесса денатурации белка (разрушение третичной и вторичной структур белковых молекул).
 
 
+ О2
Белки являются основой всего живого на Земле и выполняют в организмах многообразные функции.
Функции белков в организме
Существуют белки, выполняющие специфические функции, например, рецепторные – обеспечивают передачу импульсов между нервными клетками и др. Белки – необходимая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьезные заболевания. Задание 13 1. Напишите уравнения реакции, доказывающих амфотерные свойства a-аминокислоты лизина.
Образец выполнения:
2. Напишите уравнение реакции синтеза тетрапептида, состоящего из аланина, глицина, пролина и фениаланина.
Образец выполнения:
Задания № 13 контрольной работы 1. Напишите уравнение реакций, доказывающих амфотерные свойства a-аминокислоты:
Вариант 1 аспарагиновой кислоты Вариант 2 тирозина Вариант 3 триптофана Вариант 4 глутаминовой кислоты Вариант 5 метионина 2. Напишите уравнение реакции синтеза тетрапептида, состоящего из a-аминокислот:
Вариант 1 гистидин, глицин, лизин, аланин
Вариант 2 аланин, пролин, цистеин, серин Вариант 3 фенилаланин, валин, изолейцин, глутамин Вариант 4 аспарагиновая кислота, триптофан, лейцин, аргинин Вариант 5 тирозин, аспарагин, гистидин, пролин.
Сложные эфиры. Липиды Сложные эфиры. Жиры · Сложные эфиры – это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации). Например:
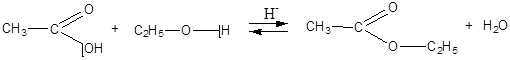
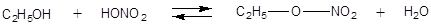
Общая формула сложных эфиров одноатомных спиртов и монокарбоновых кислот:
где R и R1 – углеводородные радикалы исключение: эфиры муравьиной кислоты
Изомерия Рассмотрим на примере С5Н10О2:
Номенклатура Названия сложных эфиров образуются из названий соответствующих кислот или кислотных остатков и названий алкильных радикалов, входящих в состав спиртов:
Физические свойства Простейшие по составу сложные эфиры карбоновых кислот – бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры – воскообразные вещества (пчелиный воск), сложные эфиры в воде растворяются плохо. Химические свойства
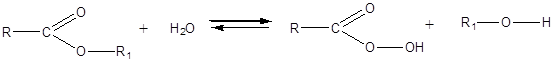
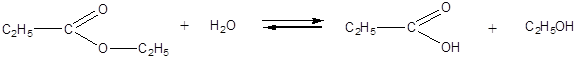
Эта реакция противоположна реакции этерификации. Ионы водорода катализируют как прямую, так и обратную реакции. Для смещения реакции в сторону образования эфира можно «связать» образующуюся воду водоотнимающим веществом (например, H2SO4 конц.). В том случае, когда необходимо провести гидролиз эфира, реакцию иногда проводят в присутствии щелочи, которая позволяет «связать» образующуюся кислоту.
Применение
Омыляемые липиды Жиры (Триглицериды) · Жиры – это смесь сложных эфиров глицерина и высших карбоновых кислот (ВКК).
Состав жиров установил в 1811 г. французский ученый Э.Шеврель, нагревая жир в водой в щелочной среде. Общая формула жира:
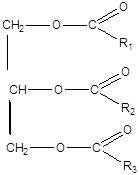
Французский химик М.Бертло в 1854 г. осуществил обратную реакцию и впервые синтезировал жир:
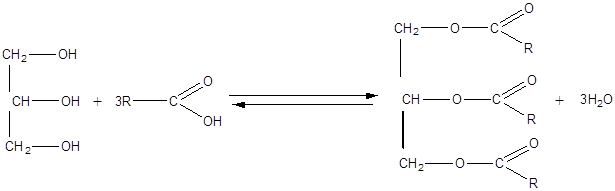
Популярное:
|
Последнее изменение этой страницы: 2016-03-16; Просмотров: 2460; Нарушение авторского права страницы