
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Зависимость подвижности ионов от концентрации и температуры, электрофоретический и релаксационный эффекты, эффекты Вина и Дебая-Фалькенгагена, уравнение Онзагера.
Числа переноса ионов, методы их определения.
СВЯЗЬ МЕЖДУ ПОДВИЖНОСТЬЮ ИОНОВ И ИХ КОНЦЕНТРАЦИЕЙ. Теория электролитической диссоциации Аррениуса не учитывала влияния концентрации на подвижность ионов, хотя, как выяснилось, влияние концентрации на подвижность может быть весьма существенным. Кольрауш вывел эмпирическое уравнение, связывающее эквивалентную электропроводность сильных электролитов с концентрацией: l = l¥ - А Так как l¥ = lо+ + lо- и l = l+ + l-, то, следовательно, l+ = lо+ - В1 где В1 + В2 = А. Дебай и Гюккель объясняли уменьшение подвижности ионов и эквивалентной электропроводности l сильных электролитов с увеличением концентрации наличием ионной атмосферы. Действительно, каждый ион окружён ионной атмосферой, состоящей преимущественно из ионов противоположного знака, плотность которой увеличивается с повышением концентрации электролита. При наложении электрического поля ион начинает двигаться в одну сторону, а ионная атмосфера - в противоположную. Движение ионов разных зарядов в противоположных направлениях создаёт как бы дополнительное трение, которое и уменьшает абсолютную скорость движения ионов. Этот эффект торможения носит название электрофоретического эффекта. По мере увеличения концентрации плотность ионной атмосферы увеличивается, следовательно, увеличивается и тормозящий электрофоретический эффект. При движении ион покидает свою ионную атмосферу и непрерывно на пути своего движения создаёт новую. Этот процесс разрушения старой и образования новой ионной атмосферы протекает хотя и быстро, но не мгновенно, вследствие чего при движении иона нарушается симметричность ионной атмосферы, причём плотность её больше позади движущегося иона. Появление асимметрии ионной атмосферы также вызывает некоторое торможение движения иона, которое получило название эффекта асимметрии или релаксации. Таким образом, из-за наличия ионной атмосферы при движении иона возникают два тормозящих эффекта: электрофоретический, обусловленный движением ионной атмосферы в сторону, противоположную направлению движения иона, и эффект релаксации, обусловленный асимметрией ионной атмосферы. Убедительным подтверждением правильности представлений Дебая и Гюккеля является так называемый эффект Вина. Если уменьшение подвижности ионов с увеличением концентрации объясняется наличием ионной атмосферы, то уничтожение последней должно привести к возрастанию подвижности и электропроводности до предельного значения. Поскольку скорость движения иона пропорциональна напряжению, а скорость образования ионной атмосферы является конечной величиной, то путём увеличения напряжённости можно добиться такой большой скорости движения ионов, при которой ионная атмосфера уже не будет успевать образовываться. Тогда ионы будут обладать максимальной скоростью движения и предельной подвижностью. Это и было установлено Вином, который, увеличив напряжённость поля до 200000 в/см, наблюдал увеличение эквивалентной электропроводности до предельного значения l¥ . В 1928 г. Дебай и Фалькенгаген теоретически рассмотрели влияние частоты переменного тока на электропроводность электролитов и установили, что при увеличении частоты выше некоторого значения должно наблюдаться заметное возрастание электропроводности. Явление увеличения электропроводности с частотой получило название частотного эффекта или дисперсии электропроводности. При достаточно большой частоте переменного тока взаимные смещения иона и ионной атмосферы настолько малы, что ионная атмосфера практически симметрична, а потому тормозящий эффект релаксации должен исчезнуть. При больших частотах эффект релаксации исчезает. Электрофоретический эффект остаётся, так как ионная атмосфера не уничтожается. Следовательно, частотный эффект должен быть меньшим, чем эффект Вина. Сопоставляя значения того и другого, можно расчленить суммарный эффект уменьшения электропроводности на составляющие. Эффект Вина возникает при полном уничтожении ионной атмосферы, а следовательно, и обоих эффектов торможения. Частотный эффект объясняется лишь исчезновением симметрии ионной атмосферы. Опыт показывает, что последний эффект примерно в 3 раза слабее, чем эффект Вина, то есть электрофоретический эффект в 2 раза сильнее эффекта релаксации. Опыты Вина и Дебая-Фалькенгагена являются убедительным экспериментальным доказательством реального существования ионной атмосферы и позволяют представить себе характер её строения. Представление о ионной атмосфере является одним из фундаментальных положений электростатической теории электролитов. В дальнейшем Онзагер вывел теоретическое уравнение, которое количественно связывает эквивалентную электропроводность с концентрацией и позволяет вычислить электрофоретический и релаксационный эффекты. Для бинарных одновалентных водных электролитов уравнение Онзагера имеет вид: l = l¥ - где первое слагаемое в квадратных скобках характеризует эффект релаксации, второе слагаемое характеризует электрофоретический эффект; D - диэлектрическая проницаемость, h - коэффициент вязкости, Т - температура, с - концентрация. Теоретическое уравнение Онзагера согласуется с эмпирической формулой Кольрауша (l = l¥ - А
ЗАВИСИМОСТЬ ПОДВИЖНОСТИ ИОНОВ ОТ ТЕМПЕРАТУРЫ. Предельная подвижность ионов, а также удельная электропроводность электролитов всегда увеличиваются с повышением температуры (в противоположность электропроводности металлов, которая уменьшается с повышением температуры). Температурный коэффициент подвижности оказывается довольно большим; при нагревании раствора на 1oС подвижность, а следовательно, и электропроводность возрастают примерно на 2 %. Наибольший температурный коэффициент характерен для ионов с относительно малой подвижностью и наоборот. Наличие положительного температурного коэффициента подвижности ионов, по-видимому, объясняется уменьшением вязкости с температурой. Так как l¥ = lо+ + lо- , то эквивалентная электропроводность при бесконечном разведении с температурой всегда возрастает. При конечной концентрации связь l с подвижностью несколько сложнее. Для слабого электролита l = (l+ + l-)× a. Если с повышением температуры подвижности ионов возрастают, то степень диссоциации может и уменьшаться, поскольку диэлектрическая проницаемость раствора при нагревании уменьшается, то есть силы взаимодействия между ионами увеличиваются. Следовательно, кривая зависимости электропроводности от температуры может иметь максимум. Аналогичное явление наблюдается и в сильных электролитах.
ЧИСЛА ПЕРЕНОСА ИОНОВ. Одним из важнейших понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, поэтому возникает вопрос, каково участие в этом процессе ионов каждого знака. Количество переносимого электричества определяется концентрацией ионов и скоростью их движения; когда концентрации катионов и анионов одинаковы, участие их в переносе электричества зависит лишь от относительной скорости их движения. Т.к. скорости движения катионов и анионов могут быть существенно различными, потому и числа переноса должны быть разными. Это было установлено Гитторфом (1854). Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов: t+ = I+ = t+ = Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона. Т.к. подвижности катиона и аниона изменяются с концентрацией и температурой в общем случае неодинаково, то и числа переноса зависят от концентрации и температуры, хотя эта зависимость более слабая. Выведенное соотношение позволяет вычислить числа переноса, если известны значения подвижностей ионов. С др. стороны, опытное определение чисел переноса дает возможность вычислить подвижности. Видно, что число переноса не является характеристикой только данного иона, т.к. зависит от подвижности парного с ним иона. Экспериментально числа переноса определяются по изменению концентрации ионов у электродов (метод Гитторфа). Рассмотрим схему движения ионов (переноса электричества) в растворе HCl при электролизе. Разделим мысленно ванну с электролитом на три отделения: I - анодная часть (анолит), II - центральная часть, III - катодная часть (католит). В процессе электролиза в отделении II концентрация электролита не изменяется, в отделениях I и III - изменяется. Схема А: до электролиза концентрация раствора во всех отделениях одинакова (в каждом из отделений находится по 6 пар ионов). Схема Б: абсолютная скорость движения Н+ приблизительно в 5 раз больше, чем скорость Cl-, поэтому в течение определенного промежутка времени при электролизе ионы Н+ пройдут слева направо путь, в 5 раз больший, чем ионы Сl- за то же время справа налево. В результате в катодном пространстве появится 6 лишних ионов водорода, а в анодном - столько же лишних ионов хлора. Схема В: эти ионы разряжаются на электродах и выделяются в виде газов. В анодном пространстве остается одна пара ионов, в катодном - 5 пар ионов. Убыль электролита у анода Dса (5 пар ионов) в 5 раз больше убыли электролита у катода Dск (1 пара ионов). Отношение Dса/Dск равно отношению абсолютных скоростей катиона и аниона и равно отношению их подвижностей.
I II III
|
Числа переноса определяются из соотношений:
t+ = 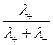 =
= 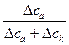 , t- =
, t- = 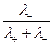 =
= 
и в рассмотренном примере t+(H+) » 5/6 = 0, 83, t-(Cl-) » 1/6 = 0, 17, откуда видно, что количество ионов данного типа, участвующих в переносе электричества, никак не связано с количеством ионов, передавших свой заряд электроду.
 Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса ; они не являются истинными, т.к. этот метод не учитывает сольватации ионов. Измеряемые в методе Гитторфа концентрации определяются не только количеством катионов и анионов, но и количеством растворителя, перенесенного этими ионами в виде сольватных оболочек. Оболочки ионов разных знаков неодинаковы по величине.
Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса ; они не являются истинными, т.к. этот метод не учитывает сольватации ионов. Измеряемые в методе Гитторфа концентрации определяются не только количеством катионов и анионов, но и количеством растворителя, перенесенного этими ионами в виде сольватных оболочек. Оболочки ионов разных знаков неодинаковы по величине.
Существование рассмотренного эффекта можно легко установить, прибавив к электролиту недиссоциирующее на ионы вещество, например, сахар или мочевину. Учитывая изменение концентрации прибавленного неэлектролита при определении чисел переноса, можно ввести поправку на перенос воды из анодного пространства в катодное в виде сольватных оболочек и найти истинные числа переноса t+ и t-. Но обычно в значения чисел переноса, найденные опытным путем по методу Гитторфа, поправки не вводятся.
Зависимость чисел переноса от концентрации обычно невелика. Однако в некоторых случаях число переноса сильно изменяется с концентрацией и может оказаться равным нулю и даже меньше нуля (например, для концентрированного раствора CdI2 t+ < 0). Это можно объяснить образованием комплексных анионов (CdI42-).
Влияние температуры на числа переноса незначительно. Во многих случаях числа переноса при повышении температуры приближаются к 0, 5, т.е. подвижности катиона и аниона становятся почти одинаковы.
Растворы одной и той же соли в разных растворителях имеют различные числа переноса; это объясняется, в основном, различной степенью сольватации катионов и анионов в зависимости от растворителя.
Лекция 43
Последнее изменение этой страницы: 2016-03-15; Просмотров: 3165; Нарушение авторского права страницы