
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Основные характеристики ковалентной связи
Ковалентная химическая связь наиболее полно может быть охарактеризована по следующим параметрам: энергия связи; длина связи; направленность связи; полярность связи; поляризуемость связи. Некоторые параметры, в частности, энергия связи, используются для характеристики и других типов химической связи.
Энергия связи Энергия связи служит мерой прочности любой химической связи. На разрыв химической связи необходимо затратить энергию, равную по величине той энергии, которая выделилась при образовании химической связи. Количество энергии, выделяющейся при образовании молекулы из атомов, называют энергией образования связи или просто энергией связи (Е СВ) . Энергию связи выражают в кДж/моль, например: Н + Н ® Н2 + 435 кДж. Естественно, столько же энергии необходимо затратить и для разрыва химических связей в 1 моль водорода. Следовательно, чем боль-ше энергия связи, тем связь прочнее. Например,
ЕСВ(Н2) = 435 кДж/моль, а ЕСВ(N2) = 942 кДж/моль. И, действительно, связь в молекуле азота (как показано ранее, тройная) значительно прочнее связи в молекуле водорода. Разрыв связи может быть осуществлен гомолитически (с образо-ванием нейтральных атомов) и гетеролитически (с образованием ионов), причем энергия разрыва может различаться: NaCl(газ) = Na (газ) + Cl (газ) – 414 кДж NaCl (газ) = Na+(газ) + Cl –(газ) – 548 кДж
Следовательно, в каждом конкретном случае следует указывать, какой процесс имеется в виду.
Длина связи Длина связи – это расстояние между центрами атомов, образующих химическую связь. Обозначают ее d и выражают в нанометрах (1 нм = 1 × 10 – 9 м) или ангстремах (1
Для однотипных молекул длина химической связи также может служить характеристикой прочности связи: ведь чем меньше длина связи, тем больше степень перекрывания электронных облаков. Так, длины связей d (HF) = 0, 092 нм и d (HJ) = 0, 162 нм свидетельствуют о большей прочности связи в молекуле фтороводорода, что подтверждается на практике. Следует отметить, что экспериментально определяемые длины связей характеризуют лишь среднее расстояние между атомами, поскольку атомы в молекулах и кристаллах совершают колебания около положения равновесия.
Направленность связи Перекрывание электронных облаков, приводящее к образованию химической связи, возможно лишь при их определенной взаимной ориентации. Область перекрывания также расположена в определенном направлении к взаимодействующим атомам. Поэтому говорят, что ковалентная химическая связь обладает направленностью. Могут возни-кать связи 3 видов, которые называют s - (сигма), p - (пи) и d - (дельта) связями. В рассмотренных в предыдущей главе случаях образования молекул Н2 и F2 перекрывание электронных облаков происходит вдоль прямой, соединяющей центры атомов. Ковалентная связь, образующаяся в результате перекрывания электронных облаков вдоль линии, соеди-няющей центры атомов, называется s-связью. s-связь образуется при перекрывании s - s – облаков (например, Н2), рх - рх – облаков (F2), s - рх – облаков (HF).
а б
в Рис. 4.3. s-связи в молекулах Н2 (а), F2 (б), HF (в) При взаимодействии р-электронных облаков, ориентированных перпендикулярно оси, соединяющей центры атомов (ру- и рz- облака) образуются две области перекрывания, расположенные по обе стороны от оси. Такое положение отвечает образованию p-связи. p-связь – это связь, для которой связывающее электронное облако имеет плоскость симметрии, проходящую через атомные ядра. p-связи не существуют сами по себе: они образуются в молекулах, уже имеющих s-связи, и приводят к появлению двойных и тройных связей. Так, в молекуле N2 каждый атом азота обладает тремя неспарен-ными 2р-электронами, облака которых ориентированы перпендикулярно друг другу. По одному облаку от каждого атома азота участвует в обра-зовании s-связи (рх - рх – перекрывание). Облака же ру- и рz-, направленные перпендикулярно линии s-связи, могут перекрываться между собой лишь боковыми сторонами «гантелей». Такое перекрывание приводит к образованию, помимо s-, двух p-связей, т.е. связь в молекуле N2 является тройной. Однако эти связи энергетически неравноценны: степень перекрывания рх - рх – облаков много выше, чем ру - ру и рz - рz. И, действительно, энергия тройной связи ниже, чем утроенная энергия одной s-связи, а при химических реакциях в первую очередь происходит разрыв p-связей. p-связи образуются при перекрывании ру - ру, рz - рz, ру - d, рz - d, d - d – облаков (рис. 4.4).
 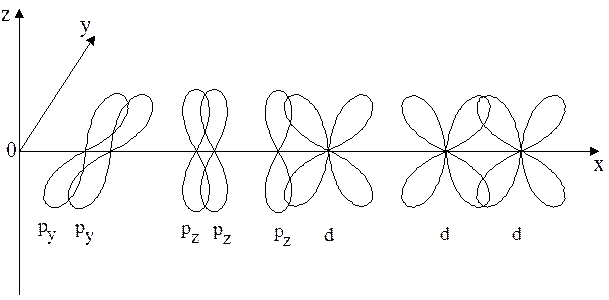
d - связь – это ковалентная связь, образованная при перекрывании d - электронных облаков всеми четырьмя лепестками (рис. 4.5). По прочности она также значительно уступает s-связи.
Рис. 4.5. Схема образования d-связи
Полярность химической связи
В двухатомных молекулах простых веществ, т.е. состоящих из атомов одного элемента (Н2, F2, N2, O2 и др.) область перекрывания электронных облаков располагается симметрично относительно ядер обоих атомов. Следовательно, центры положительных и отрицательных зарядов в молекуле совпадают, и такая связь называется неполярной (или реже гомеополярной ). Если же связь образована атомами различных элементов, электро-отрицательность которых различается (но не очень резко), то область перекрывания электронных облаков взаимодействующих атомов обычно смещена в сторону одного из атомов (обладающего большей электро-отрицательностью). В таком случае связь называют полярной (или гетерополярной ). Электронное облако тем больше смещается к электро-отрицательному атому, чем сильнее различаются электроотрицательности элементов. При этом атом более электроотрицательного элемента несет избыточный отрицательный заряд, а его партнер – избыточный положительный заряд:
H + F HF
ОЭО = 2, 1 ОЭО = 4, 0
Следовательно, в молекуле с полярной ковалентной связью центры положительных и отрицательных зарядов не совпадают. Такие системы называются электрическими диполями. Расстояние между центрами положительного и отрицательного зарядов l называется длиной диполя (рис. 4.6).
Рис. 4.6. Диполь молекулы HF
Хотя суммарный заряд диполя равен нулю, из-за разделения зарядов в пространстве образуется электрическое поле, напряженность которого пропорциональна дипольному моменту молекулы. Под дипольным моментом m понимают произведение абсолютного значения заряда электрона q на длину диполя l : m = q × Единица измерения дипольного момента – Дебай: 1Д = 3, 33 × 10 – 30 Кл × м. Именно величиной дипольного момента и характеризуется степень полярности связи. Естественно, для неполярных молекул дипольный момент равен нулю (поскольку Следует различать полярность связи и полярность молекулы. В случае двухатомных молекул, очевидно, что наличие полярной связи означает наличие диполя. В случае же многоатомных молекул в возникновении диполя играет роль и пространственное строение молекул. Так, молекула диоксида углерода линейна: О = С = О Обе связи С = О полярны, причем дипольный момент каждой отдельной связи весьма значителен ( Полярность молекул накладывает отпечаток на свойства веществ. Диполи ориентируются друг к другу разноименно заряженными полюсами, вследствие чего наблюдается взаимное притяжение между молекулами. Поэтому вещества, образованные полярными молекулами, обычно плавятся и кипят при более высоких температурах, чем неполярные вещества. Кроме того, полярность молекул сказывается и при растворении веществ в различных растворителях: вещество, состоящее из полярных молекул, лучше растворяется в полярном растворителе, и наоборот.
Популярное:
|
Последнее изменение этой страницы: 2016-08-24; Просмотров: 1028; Нарушение авторского права страницы