
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Электрическая проводимость растворов
Электролитов Электрическая проводимость (L) – это способность вещества проводить электрический ток под действием внешнего электрического поля. По физическому смыслу эта величина обратна сопротивлению(R):
где ρ – удельное сопротивление, Ом/м; S – поперечное сечение проводника, м2; l – длина проводника, м. Различают удельную и молярную электрические проводимости растворов электролитов. Удельная электрическая проводимость (κ ) – электрическая проводимость объема раствора, заключенного между двумя параллельными электродами площадью 1 м2, расположенными на расстоянии 1 м друг от друга. Удельная электрическая проводимость является величиной, обратной удельному сопротивлению.
Единицей измерения удельной электрической проводимости: Ом-1м-1=См/м (См – сименс). В электрохимии часто пользуются традиционным определением удельной электрической проводимости: это электрическая проводимость столбика вещества длиной 1 см и с сечением 1 см2, при этом размерность Ом-1см-1=См/см.
При увеличении концентрации растет плотность раствора, что снижает скорость движения ионов, при этом у слабых электролитов заметно снижается степень диссоциации; поэтому κ для умеренно слабых электролитов начинает уменьшаться в области значительно более разбавленных растворов и роста электропроводности практически не наблюдается, а максимум на кривой получается очень пологим. Повышение температуры на 1 К увеличивает удельную электропроводность на 2–2, 5 % для сильных электролитов за счет понижения вязкости раствора и уплотнения гидратированных ионов, а для растворов слабых электролитов – за счет увеличения степени диссоциации в случае эндотермической реакции растворения электролита. На величину удельной электрической проводимости, кроме перечисленных факторов, влияет валентность (заряд) иона: чем больше заряд иона, тем большее количество электричества он переносит. Молярная электрическая проводимость (λ ) – электрическая проводимость объема раствора электролита, содержащего 1 моль-эквивалент растворенного вещества, находящегося между двумя параллельными электродами, расположенными на расстоянии 1 м друг от друга. Единицей измерения молярной электрической проводимости является: См∙ м2/моль. Удельная и молярная электрические проводимости связаны между собой соотношением:
где С – молярная концентрация растворенного вещества, моль/л; λ – молярная электрическая проводимость, См∙ м2/моль; κ –удельная электрическая проводимость, См/м. Зависимость λ от скорости движения для одно-одновалентных ионов выражается уравнением:
где u+ и u- – абсолютные скорости движения положительных и отрицательных ионов соответственно, α – степень диссоциации электролита, F – постоянная Фарадея. Для сильных электролитов можно принять a = 1, поэтому
Произведения
Для предельно разбавленных растворов (С→ 0, α → 1) справедливо равенство:
где Уравнение (5.25) справедливо как для сильных, так и для слабых электролитов и называется законом независимого движения ионов Кольрауша (законом аддитивности электрической проводимости). Согласно закону Кольрауша, молярная электрическая проводимость при предельном разведении равна сумме подвижностей ионов при предельном разведении. Численные значения подвижностей ионов Сравнение численных значений В разбавленных растворах слабых электролитов электрическое взаимодействие между ионами мало, поэтому:
Из выражения (5.26) следует, что степень диссоциации раствора слабого электролита при изменении концентрации можно определить, используя экспериментальные данные значений молярной электрической проводимости его разбавленных растворов. Так как В растворах сильных электролитов изменение молярной электрической проводимости с концентрацией обусловлено влиянием электростатического взаимодействия ионов на скорость их движения. График зависимости молярной электрической проводимости от концентрации раствора для слабых электролитов выражается более крутым уменьшением
По этой теории уменьшение молярной электрической проводимости разбавленных растворов сильных электролитов при увеличении концентрации электролита объясняется уменьшением скорости движения ионов за счет электростатического взаимодействия ионов, окруженных их ионными атмосферами, при движении таких ионов в электрическом поле.
Кондуктометрия Кондуктометрия – метод исследования, основанный на измерении электрической проводимости растворов электролитов. Этот метод достаточно прост, точен, позволяет решить ряд важных научно-исследовательских и производственных задач. Измеряя электрическую проводимость растворов, определяют основность органических кислот, растворимость и произведение растворимости малорастворимых соединений, константу и степень диссоциации слабых электролитов, степень минерализации почв, вод и грунтов. Широко используется кондуктометрическое титрование различных (особенно мутных) растворов. Экспериментальное определение электрической проводимости раствора электролита основано на измерении сопротивления раствора при прохождении электрического тока методом компенсации. Для этого используется мостовая схема (рис.5.3):
Рис.5.3. Схема установки для измерения электрического сопротивления раствора: АВ – реохорд с фиксированными значениями сопротивлений в различных положениях скользящего контакта С; Rм – магазин сопротивлений; Rx – сосуд с исследуемым раствором, сопротивление которого следует определить; Г – нуль-инструмент (гальванометр или осциллограф); 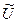 – генератор тока высокой частоты. – генератор тока высокой частоты.
Перемещая контакт С по реохорду АВ, добиваются отсутствия тока или его минимума в цепи CD. При этом справедливо соотношение:
Переменный ток высокой частоты (в схеме измерения) используется для того, чтобы избежать последствий электролиза на электродах в сосуде с исследуемым раствором и для уменьшения емкостного сопротивления.
Пример 5.3. Две никелевые пластины, площадью по 4 см2 каждая, расположены параллельно друг другу на расстоянии 11 см. Пространство между ними заполнено раствором 0, 34 М NiSO4. Молярная электрическая проводимость этого раствора равна 98, 7 См·см2/моль. Какое переменное напряжение должно быть приложено к пластинам, чтобы сила тока была равна 0, 07 А? Решение: 1. Для расчета сопротивления раствора рассчитаем удельную электрическую проводимость из значений молярной электрической проводимости:
2. Рассчитаем сопротивление раствора:
3. Рассчитаем по закону Ома напряжение, приложенное к электродам:
Пример 5.4. Удельная электрическая проводимость 0, 05 М раствора роданида аммония равна 0, 572·10-2 См/см. Рассчитайте степень диссоциации соли. Решение: 1. Рассчитываем молярную электрическую проводимость по уравнению (5.21):
2. По справочнику находим значения подвижностей ионов и рассчитываем 3. Степень диссоциации роданида аммония рассчитываем по уравнению (5.26):
Пример 5.5. Молярная электрическая проводимость 0, 02 М раствора уксусной кислоты равна 12, 77 См·см2/моль. Вычислите константу диссоциации и рН этого раствора. Решение: 1. Согласно справочным данным при 25°С предельная молярная электрическая проводимость уксусной кислоты составит: 2. Рассчитаем степень диссоциации уксусной кислоты по уравнению (5.26):
3. Рассчитаем константу диссоциации уксусной кислоты по уравнению (5.2):
4. Так как уксусная кислота является слабым электролитом, то концентрация ионов водорода, полученных в результате электролитической диссоциации кислоты, будет равна:
5. Рассчитаем рН раствора уксусной кислоты:
Электролиз
Электролиз – процесс, в котором химические реакции идут под действием электрического тока от внешнего источника, при этом электрическая энергия превращается в химическую. Путем электролиза можно осуществлять реакции, самопроизвольное протекание которых невозможно. Электролиз проводят в электролизерах (электрохимических ячейках), состоящих из двух электродов, погруженных в раствор электролита. Отрицательно заряженный электрод, на котором происходит процесс восстановления (присоединения электронов), называется катодом:
Положительно заряженный электрод, на котором происходит процесс окисления (отдача электронов), называется анодом:
В результате электролиза на электродах происходит выделение вещества из раствора электролита и изменение его состава возле поверхности электродов. Химические превращения при электролизе зависят от природы электролита и растворителя, материала электрода и присутствия других веществ в растворе.
Популярное:
|
Последнее изменение этой страницы: 2016-08-31; Просмотров: 6940; Нарушение авторского права страницы