
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Термодинамика. Первое начало термодинамики
Некоторые общие понятия термодинамики В то время как молекулярно-кинетическая теория истолковывает свойства тел, которые наблюдаются на опыте, как суммарный результат действия молекул (квазичастиц), термодинамика изучает свойства и изменения состояния вещества, не интересуясь микроскопической картиной. В основе термодинамики лежит несколько фундаментальных законов, установленных на основе обобщения большой совокупности опытных фактов; это требует введения соответствующих понятий. Рассмотрим их. Термодинамической системой или просто системой будем называть любую физическую систему, состоящую из большого ансамбля частиц – атомов и молекул, которые совершают бесконечное тепловое движение и, взаимодействуя между собой, обмениваются энергиями. Такими системами, и притом простейшими, являются газы, молекулы которых совершают беспорядочное поступательное и вращательное движения и при столкновениях обмениваются кинетическими энергиями; не являются исключением твёрдые тела и жидкости. Любая система может находиться в различных состояниях, отличающихся термодинамическими параметрами. Для системы «идеальный газ» такими являются Т, V, Р, в том числе сортность (m, М) и масса (m) газа. При неизменных внешних условиях равновесное состояние остаётся постоянным сколь угодно долго и может быть нарушено лишь воздействием извне. Любое равновесное состояние системы может быть изображено точкой на графике, если по координатным осям х, у откладывать значения каких-либо параметров. Для идеального газа в осях V, Р равновесные состояния 1 и 2 представлены на рис. 6.1.. Каждому состоянию соответствуют свои параметры давления Р и объёма V; сортность и масса газа неизменны.
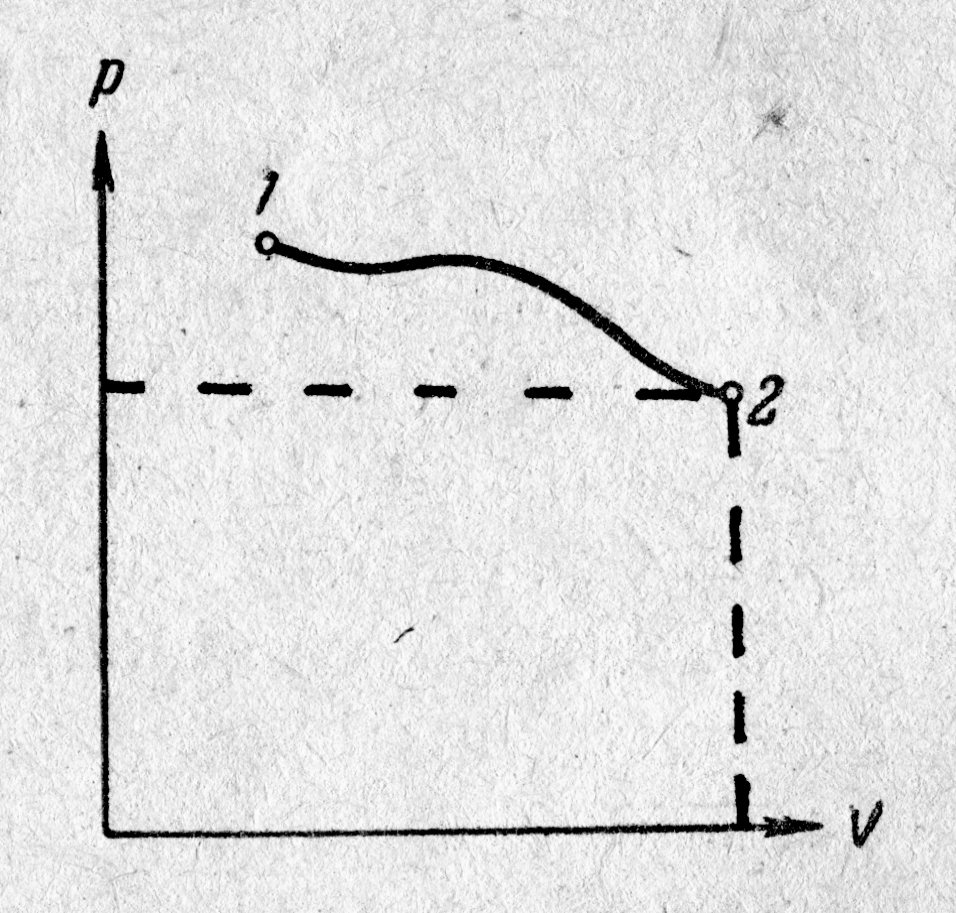 Если какой-либо параметр системы, несмотря на отсутствие внешних воздействий, в разных точках её неодинаков, состояние системы называют неравновесным. Если система изолирована от других тел и представлена самой себе, параметр системы выравнивается и примет одинаковое для всех точек значение – система перейдёт в равновесное состояние. Время перехода системы из неравновесного состояния в равновесное называется временем релаксации. Обратный переход из равновесного состояния в неравновесное может быть осуществлён при помощи внешних воздействий на систему. Неравновесным является, в частности, состояние системы с различными температурами в различных местах; например, выравнивание температуры в газах, твёрдых и жидких телах есть переход этих тел в равновесное состояние с одинаковой температурой в пределах всего объёма тела. В неравновесном состоянии может находиться и двухфазная система, состоящая из жидкости и её пара. Если над поверхностью жидкости, находящейся в закрытом сосуде, имеется ненасыщенный пар, то состояние системы неравновесное: число молекул N1, покидающих жидкость в единицу времени, больше, чем число молекул N2, возвращающихся за это же время из пара в жидкость. Вследствие этого с течением времени число молекул в парообразном состоянии увеличивается до тех пор, пока не установится равновесное состояние с N1 = N2. Неравновесное состояние не может быть отображено на графике, потому что хотя бы один из параметров не будет иметь в неравновесном состоянии определённого значения. Если какой-либо параметр системы, несмотря на отсутствие внешних воздействий, в разных точках её неодинаков, состояние системы называют неравновесным. Если система изолирована от других тел и представлена самой себе, параметр системы выравнивается и примет одинаковое для всех точек значение – система перейдёт в равновесное состояние. Время перехода системы из неравновесного состояния в равновесное называется временем релаксации. Обратный переход из равновесного состояния в неравновесное может быть осуществлён при помощи внешних воздействий на систему. Неравновесным является, в частности, состояние системы с различными температурами в различных местах; например, выравнивание температуры в газах, твёрдых и жидких телах есть переход этих тел в равновесное состояние с одинаковой температурой в пределах всего объёма тела. В неравновесном состоянии может находиться и двухфазная система, состоящая из жидкости и её пара. Если над поверхностью жидкости, находящейся в закрытом сосуде, имеется ненасыщенный пар, то состояние системы неравновесное: число молекул N1, покидающих жидкость в единицу времени, больше, чем число молекул N2, возвращающихся за это же время из пара в жидкость. Вследствие этого с течением времени число молекул в парообразном состоянии увеличивается до тех пор, пока не установится равновесное состояние с N1 = N2. Неравновесное состояние не может быть отображено на графике, потому что хотя бы один из параметров не будет иметь в неравновесном состоянии определённого значения.Переход физической системы из одного состояния в другое через какую-то последовательность промежуточных состояний называется процессом. Процесс называется обратимым, если изменения в системе можно провести в обратном направлении через те же промежуточные состояния, через которые проходила система в прямом направлении. При обратном переходе не только сама система, но и связанные с нею окружающие тела в точности возвращаются в первоначальное состояние. Переход системы из одного состояния в другое связан с нарушением равновесия системы. Следовательно, при протекании в системе какого-либо процесса она проходит через последовательность неравновесных состояний. Процесс называется равновесным, если начальное, конечное и все промежуточные состояния системы являются равновесными. Отсюда следует, для равновесности процесса, происходящего внутри термодинамической системы, существование или отсутствие «остаточных изменений» в окружающих телах не имеет значения; важно только, чтобы каждое из промежуточных состояний системы было равновесным. Промежуточные состояния могут быть равновесными только в двух предельных случаях: скорость внешнего воздействия бесконечно мала; скорость процессов релаксации (переход системы из неравновесного состояния в равновесное) бесконечно велика. Равновесный процесс может быть изображён на графике соответствующей кривой (рис.6.1.). Неравновесные процессы, как правило, условно изображаются пунктирными кривыми. Понятия равновесного состояния и равновесного процесса играют большую роль в теоретической термодинамике. Все количественные выводы термодинамики строго применимы только к равновесным процессам.
Внутренняя энергия термодинамической системы. Первое начало термодинамики Термодинамическая система, как и любая другая физическая система, состоит из большого ансамбля обособленных частиц. Эти частицы совершают бесконечное тепловое движение и взаимодействуют между собой. Следовательно, внутренняя энергия системы есть сумма всех видов кинетической и потенциальной энергии всех составных частей системы: тел, их молекул, атомов, электронов. Таким образом, в состав внутренней энергии входит кинетическая энергия поступательного и вращательного движений атомов и молекул, энергия их колебательного движения, потенциальная энергия взаимодействия атомов и молекул, кинетическая и потенциальная энергия электронов в атомах, внутриядерная энергия. Однако в большинстве физических явлений, в которых участвуют термодинамические системы, не все перечисленные виды энергии испытывают изменения. В частности, внутриатомная энергия в таких процессах не участвует. Поэтому, употребляя понятие внутренней энергии, имеют в виду не полную энергию данной системы, а только ту её часть, которая изменяется в рассматриваемых явлениях. Внутренняя энергия системы является однозначной функцией её состояния. Это означает, в каждом определённом состоянии система обладает вполне определённым значением внутренней энергии; всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от процесса, приведшего систему из одного состояния в другое. Следовательно, при переходе системы из одного состояния в другое изменение её внутренней энергии Внутренняя энергия термодинамической системы может быть рассчитана в зависимости от значений всех физических величин, определяющих это состояние: V, Р, Т и т. д. Для тел, находящихся в твёрдом или жидком состоянии расчёт внутренней энергии затруднён и требует использования упрощающих предположений. Однако имеется довольно простой путь расчёта внутренней энергии для разряжённого газа в зависимости от его температуры. В параграфе 5.1. рассмотрена модель идеального газа; его частицы в среднем находятся далеко друг от друга и слабо взаимодействуют между собой. При этих условиях потенциальной энергией взаимодействия частиц можно пренебречь и тогда внутренняя энергия идеального газа определяется только кинетической энергией теплового движения его частиц. В последнем абзаце параграфа 5.2. показано, кинетическая энергия теплового движения частицы В самом общем случае рассматриваемая термодинамическая система, обмениваясь энергией со средой или окружающими телами, может получать или отдавать количество теплоты Q, может производить работу или над ней может быть произведена работа А. Следовательно, тепло и работа – две формы, в которых энергия системы может передаваться среде или, наоборот, энергия среды может передаваться термодинамической системе. По закону сохранения энергии исключается возможность каких-либо потерь при энергетическом обмене. Естественно, разность энергий термодинамической системы в двух состояниях должна равняться сумме теплоты и работы, полученных системой из окружающей среды:
здесь dА – работа, совершаемая системой над внешними телами, при этом Работа в термодинамике Ранее, в параграфе 6.1., мы говорили о равновесных состояниях термодинамической системы; в этих состояниях параметры системы одинаковы во всём её объёме. Приступая к рассмотрению работы в термодинамических системах, следует ожидать, что её совершение связано с изменением объёма системы. И тогда возникает вопрос, о каких же процессах идёт речь, если рассмотрению подлежат равновесные состояния? Ответ состоит в следующем: если процесс идёт медленно, то значения параметров состояния во всём объёме можно считать одинаковыми. Понятие «медленно» здесь следует уточнить. Прежде всего, оно связано с понятием «время релаксации» – временем, в течение которого устанавливается равновесие в системе. Нас сейчас интересует время выравнивания давления в системе (время релаксации), когда термодинамической системой совершается работа, связанная с изменением объёма; для однородного газа это время составляет ~ 10–16 с. Очевидно, время релаксации достаточно незначительно по сравнению со временем протекания процессов в реальных термодинамических системах (или по сравнению со временем измерения). Естественно, мы вправе считать, что реальный процесс есть последовательность равновесных состояний и поэтому имеем право, изобразить его линией на графике V, P (рис. 6.1.). Разумеется, по осям координатной системы могут откладываться объём и температура или давление и температура. Поскольку в алгебре, и не только, при построении графиков первой координатной осью читается и записывается х, а затем – у, т. е.«х, у», есть надежда, что читатель, прочитывая «оси координатной системы V, Р», предполагает – по оси х откладывается объём V, а по оси у – давление газа Р. Ознакомимся с видом линий, отображающих графически простейшие процессы в системе координат, по осям которой отложены параметры состояния V, P (возможны иные координатные оси). Выбор координатной системы обусловлен тем, что площадь, ограниченная кривой процесса и двумя крайними координатами для начального и конечного значений объёма, равна работе сжатия или расширения. На рис. 6.2. приведены графики изопроцессов, проведённые из одного и того же начального состояния. Кривая адиабатического процесса (адиабата) идёт круче, чем для изотермического процесса (изотерма). Это обстоятельство можно объяснить на основании уравнения Клапейрона для состояния газов:
Выражая из уравнения состояния Р1 и Р2, разность давлений при расширении газа от объёма V1 до объёма V2 запишется:
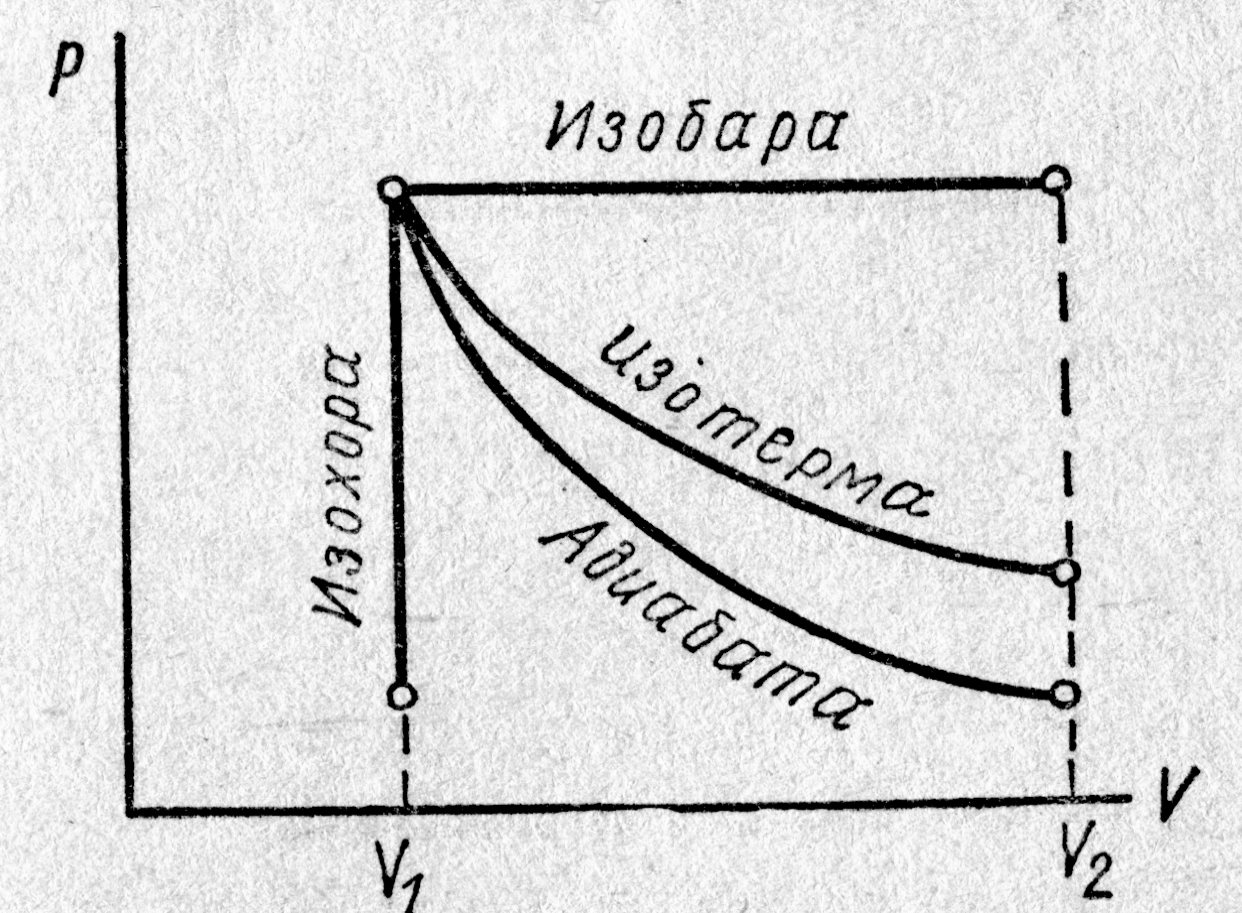
Здесь, как и в уравнении ( 2 ), При адиабатическом расширении работа над внешними телами совершается только за счёт внутренней энергии газа, вследствие чего внутренняя энергия, а вместе с ней и температура газа уменьшаются; т. е. в конце адиабатического процесса расширения (см. рис. 6.2.) Т2 Осознав, что мы имеем дело с равновесными процессами и ознакомившись с их графическим отображением в системе координат (V, P), перейдём к поиску аналитического выражения внешней работы, совершаемой термодинамической системой. Работа, совершаемая системой, может быть вычислена в зависимости от значения внешних сил, действующих на систему, и от величины деформации системы – изменения её формы и размеров. Если внешние силы приложены по поверхности в виде, например, внешнего давления, сжимающего систему, то расчёт внешней работы может быть произведён в зависимости от изменения объёма системы. Для иллюстрации рассмотрим процесс расширения газа, заключённого в цилиндре с поршнем (рис. 6.3.). Допустим, что внешнее давление на всех участках по поверхности цилиндра одно и то же. Если при расширении системы поршень сместился на расстояние В заключение этого параграфа следует заметить, теплообмен между системой и окружающей средой зависит не только от параметров начального и конечного состояний системы, но и от той последовательности промежуточных состояний, через которые проходит система. Это следует из первого закона термодинамики: Q = U2 – U1 + A, где U1 и U2 определяются только заданием параметров начального и конечного состояний, а внешняя работа A зависит, кроме того, ещё и от самого процесса перехода. Вследствие этого теплота Q, полученная или отданная системой при переходе из одного в другое состояние, не может быть выражена в зависимости только от температуры её начального и конечного состояний. Завершая экскурс в раздел «Термодинамика. Первое начало термодинамики», перечислим его ключевые понятия: термодинамическая система, термодинамические параметры, равновесное состояние, равновесный процесс, обратимый процесс, внутренняя энергия системы, первое начало термодинамики, работа термодинамической системы, адиабатический процесс.
Популярное:
|
Последнее изменение этой страницы: 2017-03-11; Просмотров: 906; Нарушение авторского права страницы