
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Цикл Карно. К.П.Д. цикла. Второе начало термодинамики⇐ ПредыдущаяСтр 17 из 17
В конце предыдущего параграфа сказано, что для тепловой машины, рабочим веществом которой является идеальный газ, необходимы два тепловых резервуара, имеющие температуры Предполагаемый цикл, естественно, должен состоять из процесса, в ходе которого рабочее вещество обменивается теплом с резервуаром, а также из процесса, не сопровождающегося теплообменом с внешней средой. Последнее обусловлено тем, что система должна отдавать безвозвратно часть энергии во внешнюю среду, чтобы процесс был замкнутый. Процесс, сопровождающийся теплообменом, может быть обратимым только в том случае, если, получая тепло от резервуара с Чтобы работа в замкнутом цикле была больше нуля, температура в процессе расширения должна быть больше, чем при сжатии, Всё это наводит на мысль, что обратимый цикл, совершаемый системой, вступающей в теплообмен с двумя тепловыми резервуарами бесконечно большой ёмкости, может состоять только из двух изотерм при температурах резервуаров и двух адиабат. Впервые такой цикл был введён в рассмотрение французским инженером Сади Карно и носит название цикла Карно. На графике в координатах (р, V) цикл выглядит так, как это показано на рис. 8.2..
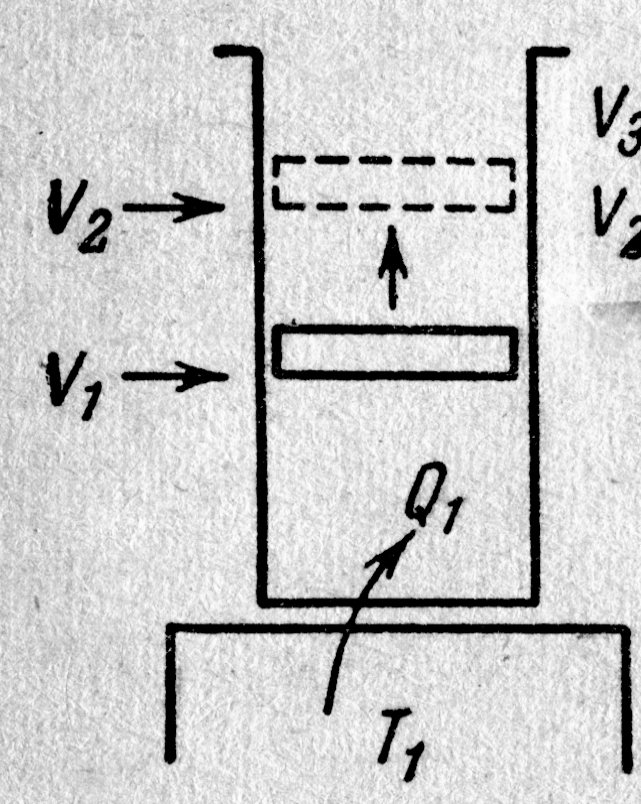 Пусть первоначально поршень занимает положение, отвечающее объёму V1 и температуре газа Т1,. Поставим цилиндр на резервуар, имеющий температуру Т1, рис. 8.2.а., и предоставим газу возможность расширяться до объёма V2. При этом газ получит от нагревателя тепло Q1. Поскольку при изотермическом процессе внутренняя энергия идеального газа остаётся постоянной, количество полученного газом тепла Q1 равно работе А12, совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 8.2.). Количество тепла, согласно формуле (12), равно: Пусть первоначально поршень занимает положение, отвечающее объёму V1 и температуре газа Т1,. Поставим цилиндр на резервуар, имеющий температуру Т1, рис. 8.2.а., и предоставим газу возможность расширяться до объёма V2. При этом газ получит от нагревателя тепло Q1. Поскольку при изотермическом процессе внутренняя энергия идеального газа остаётся постоянной, количество полученного газом тепла Q1 равно работе А12, совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 8.2.). Количество тепла, согласно формуле (12), равно:
Снимем цилиндр с резервуара с температурой Т1, закроем дно теплоизолирующей крышкой и дадим возможность газу расширяться адиабатически из состояния 2 до состояния 3, рис. 8.2.. Совершая работу по расширению за счёт внутренней энергии, газ охладится, поэтому температура понизится до значения Т2
Исходя из формулы (12), количество отданного тепла равно:
Пытливый читатель должен в этом убедиться самостоятельно. Для того чтобы цикл был замкнутым, нужно, чтобы состояния 4 и 1 лежали на одной и той же адиабате. Это возможно, если выполняется условие (17), из которого следует, см. рис.8.2.:
Разделив выражение (24) на (25), читатель, привыкший проверять преобразования, приходит к условию замкнутости цикла:
Здесь вдумчивый читатель на знаковом (словесном) языке должен пояснить себе, почему выражение (26) является условием замкнутости цикла, в частности, цикла Карно. Успех пытливого читателя потребует осознания арифметической операции деления и необходимости передачи тепла холодильнику. Предыдущие усилия по поиску коэффициента полезного действия замкнутого цикла позволили выяснить, к.п.д. обратимой машины не зависит от её устройства и свойств рабочего вещества, но определяется темперой нагревателя и холодильника. Однако вид зависимости к.п.д. от температуры нагревателя и температуры холодильника остался невыясненным. Проведённое выше рассмотрение цикла Карно, позволяет устранить обозначенную проблему. Действительно, установленная аналитическая зависимость количества тепла Q1(Т1) получаемого рабочим веществом и отдаваемого холодильнику тепла Q2(Т2) позволяют установить зависимость к.п.д. от обозначенных температур. Подставляя формулу (22) теплоты Q1 и Q2 (23) в уравнение к.п.д. тепловой машины (21), найдём:
Наконец, учитывая равенство (26), получаем:
Таким образом, к.п.д. любой обратимой машины и цикла Карно, в частности, оказывается «чувствительным» к температуре нагревателя и холодильника. Пытливый читатель, проведя преобразования, убедился в этом? Рассматривая замкнутый цикл тепловой машины, мы пришли к выводу о неизбежности передачи части тепла от нагревателя к холодильнику; см. уравнение (20). Впервые это было высказано Сади Карно в 1824 году, а позднее обобщено Клаузиусом и Томсоном в принцип невозможности осуществления такого периодического процесса, единственным результатом которого было бы получение работы за счёт взятого количества тепла от одного источника. В этом и состоит суть второго начала термодинамики. Данная формулировка второго начала не единственная. Не возможен периодически действующий механизм, который всё получаемое от нагревателя количество теплоты целиком переводил бы в работу; часть этого количества теплоты должна быть отдана холодильнику. А вот ещё один, самый короткий; «круговые процессы, в течение которых система только получает, но не отдаёт теплоту, невозможны».
Понятие энтропии Всё, что нам удалось выяснить выше, позволяет утверждать, любая тепловая машина представляет собой некую систему тел, многократно повторяющую один и тот же цикл. Из уравнений (21) и (27) следует, к.п.д. необратимой машины всегда меньше чем обратимой. Дествительно, уменьшение эфективности необратимой машины обусловлено тем, что при достаточно быстром цикле давление не успевает выравниваться и при расширении давление газа под поршнем будет меньше чем то, которое было при аналогичном положении поршня в обратимом цикле, а при сжатии, наоборот – несколько больше. В результате положительная работа необратимой машины при расширении уменьшается, тогда как отрицательная работа при сжатии увеличивается. Кроме того, трение, которое нельзя исключить, всегда связано с превращением работы в теплоту, а потому является типичным необратимым процессом. Из-за трения часть работы превращается в тепло, которое перейдёт холодильнику или рассеется в окружающую среду. Таким образом, соотношение между к.п.д. необратимой и обратимой тепловой машиной можно записать аналитически следующим образом:
Левая часть равенства отражает общее определение к.п.д., пригодное для любой тепловой машины, правая часть отражает к.п.д. обратимой машины. Естественно, знак равенства будет соответствовать обратимой, а знак неравенства – необратимой машине. Разделив почленно в левой и правой частях выражении (28), а затем умножив обе части на –1, настойчивый читатель получит соотношение:
Сгруппировав слева термодинамические величины холодильника, а справа – нагревателя, читатель получает соотношение вида:
Наконец, вычитая из левой и правой частей уравнения (28.а)
В соотношение (29) входит как тепло получаемое системой, так и тепло отдаваемое ею. Если рассматривать теплоты, получаемые системой от других тел как алгебраические величины, т. е.
Это соотношение носит название неравенства Клаузиуса. Поскольку отношение Q/Т принято называть приведённым количеством тепла, содержание уравнения (30) можно прочесть следующим образом: если какая-то система совершает цикл, в ходе которого вступает в теплообмен с двумя тепловыми резервуарами, температуры которых постоянны, то сумма приведённых количеств тепла равна нулю, если цикл обратим, и меньше нуля, если цикл необратим.
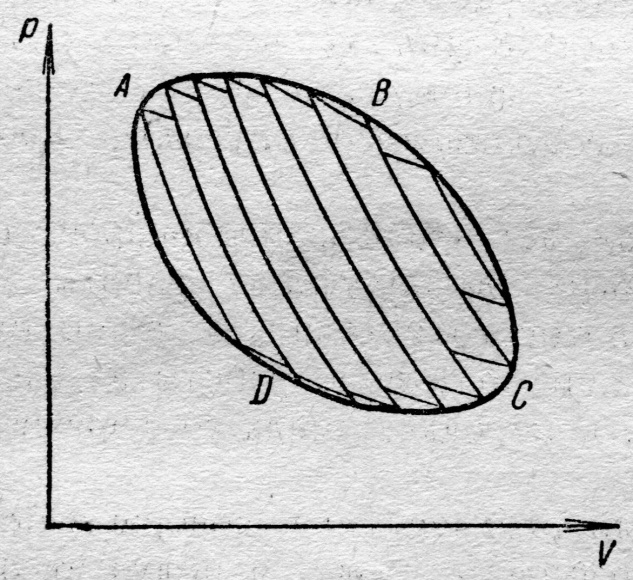 Таким образом, мы пришли к ввыоду: сумма приведённых количеств тепла, полученных системой при обратимом переходе из одного (начального) состояния в другое (конечное), не зависит от пути, по которому совершается переход, и, следовательно, зависит только от начального и конечного состояний. В этом легко убедиться. Возьмём произвольный замкнутый процесс, например, изображаемый графически замкнутой кривой ABCDA (рис. 8.3.). Этот процессс может быть приближённо разбит на бесконечное множество бесконечно узких циклов Карно. При осуществлении всех этих циклов Карно части каждой из адиабат, проходимые дважды в противоположных направлениях, выпадут. Останутся изотермы и краевые участки адиабат, образующие в совокупности замкнутую ломаную линию. В пределе эта линия даст обход по циклу ABCDA. Для каждого из элементарных циклов Карно справедлива формула (30): Таким образом, мы пришли к ввыоду: сумма приведённых количеств тепла, полученных системой при обратимом переходе из одного (начального) состояния в другое (конечное), не зависит от пути, по которому совершается переход, и, следовательно, зависит только от начального и конечного состояний. В этом легко убедиться. Возьмём произвольный замкнутый процесс, например, изображаемый графически замкнутой кривой ABCDA (рис. 8.3.). Этот процессс может быть приближённо разбит на бесконечное множество бесконечно узких циклов Карно. При осуществлении всех этих циклов Карно части каждой из адиабат, проходимые дважды в противоположных направлениях, выпадут. Останутся изотермы и краевые участки адиабат, образующие в совокупности замкнутую ломаную линию. В пределе эта линия даст обход по циклу ABCDA. Для каждого из элементарных циклов Карно справедлива формула (30):
Здесь
Переходя к бесконечно большому числу бесконечно узких циклов (число циклов n стремится к бесконечности, рис. 8.3.), обнаружим, ломаная линия превращается в кривую ABCDA, а сумма формулы (31) – в интегралы:
Из равенства нулю интеграла (32) следует, что подынтегральное выражение, Поскольку энтропия – функция состояния, сумма приращений энтропии должна быть равна разности значений энтропии в конечном и начальном состояниях:
Энтропия – аддитивная (прибавляемая) величина, что означает, энтропия системы равна сумме энтропий отдельных её частей. Введение понятия энтропии даёт ответ на вопрос, в каком направлении будет протекать реальный тепловой процесс: возможны лишь такие процессы, которые ведут к увеличению энтропии изолированной системы – принцип возрастания энтропии. Можно считать, что это ещё одна формулировка второго начала термодинамики. Первая формулировка состояла в том, что получение заданного количества работы возможно только в том случае, если часть тепла передана холодильнику. В качестве примера принципа возрастания энтропии рассмотрим процесс теплообмена, протекающий в изолированной системе между телом с температурой Т1 и телом с температурой Т2 < Т1. Первое отдаёт количество тепла –DQ, а второе получает количество тепла +DQ. Этот процесс необратим и должен сопровождаться возрастанием энтропии. Для простоты преобразований предположим, что теплоёмкость обоих тел одинакова и равна С. Из закона сохранения внутренней энергии следует: U1 + U2 = U, тогда значение установившейся температуры: Процесс охлаждения тела с температурой Т1 сопровождается уменьшением его энтропии:
Обратим внимание читателя на то, что Т2 < Туст.< Т1, отсюда немедленно следует, тело с более высокой температурой охлаждается и DS1 – отрицательно; Туст.< Т1, а логарифм числа меньшего единицы – отрицателен. Процесс нагревания второго тела сопровождается увеличением его энтропии:
Поскольку Т2 < Туст., DS2 – положительно, так как под логарифмом число больше единицы; убедились? Изменение энтропии системы запишется:
Если учесть, что логарифм частного равен разности логарифмов, а сумма логарифмов равна логарифму произведения, то читатель, заботящийся о себе, а потому проведя простые, но весьма нужные, преобразования в уравнении (34), придёт к выражению:
Наконец, проделав ещё раз математическую операцию, разность логарифмов равна логарифму частного, окончательное выражение для приращения энтропии системы в процессе теплообмена двух тел примет вид:
Если в выражении (35) под логарифмом число больше единицы, то логариф его положителен и, следовательно, энтропия системы возрастает, DS > 0. Покажем, что выражение (35) действительно больше нуля. Для этого преобразуем выражение, стоящее под знаком логарифма с учётом того, что
Пытливый читатель, разделив его почленно на знаменатель и обнаружив квадрат разности, приходит к выражению:
Очевидно, что полученное выражение больше единицы, логарифм его положителен, следовательно энтропия системы возрастает. Вдумчивы читатель не должен избегать приведённых преобразований, поскольку они содержатся в основном курсе физики, а потому при изучении его будет сам себе благодарен, что не поленился когда-то вникать в предлагаемые преобразования. Завершая экскурс в раздел «Круговые процессы», перечислим его ключевые понятия: замкнутые циклы, к.п.д. цикла, второе начало термодинамики, обратимый процесс, энтропия.
Библиографический список
Основной список 1. Бондарев, Б.В. Курс общей физики: Учеб. пособие / Б.В. Бондарев, Г.Г. Спирин. – М.: Высш. шк., 2005. – 560 с. 2. Волькенштейн, В.С. Сборник задач по общему курсу физики / В.С. Бондарев. – Изд. 3-е, испр. и доп.. – СПб.: Книжный мир, 2004. – 328 с. Вспомогательный список 3. Геворкян, Р.Г. Курс физики: Учеб. пособие / Р.Г. Геворкян. – М.: Высшая школа, 1979. – 656 с. 4. Иродов И.Е. Задачи по общей физике. Учеб. Пособие для вузов. 4-е изд., исправленное. – М.: Лаборатория Базовых Знаний, 2001. – 432 с. 5. Китайгородский, А.И. Введение в физику / А.И. Китайгородский. – М.: Наука. Главная редакция физ.-мат. литературы, 1973. – 688 с. 6. Савельев, И.В. Курс общей физики: Т.1: Механика, колебания и волны, молекулярная физика / И.В. Савельев. – М.: Наука, 1973. – 511 с. 7. Суханов, А.Д. Фундаментальный курс физики. Учеб. пособие по физике. В 4-х томах. Том II. Континуальная физика / А.Д. Суханов. – М.: Изд-во «Агар», 1998. – 709 с. 8. Яворский, Б.М. Основы физики: Учебное пособие. В двух томах; Т.1, Механика. Молекулярная физика. Электродинамика. Т.2, Колебания и волны; Основы квантовой физики атомов, молекул и твёрдых тел; физика ядра и элементарных частиц. / Б.М. Яворский, А.А. Пинский. – М.: Наука. Главная редакция физ.-мат. литературы, 1981. – 480 с.; М.: Наука, 1974. – 464 с. Популярное:
|
Последнее изменение этой страницы: 2017-03-11; Просмотров: 570; Нарушение авторского права страницы