
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Органические лекарственные препараты.Стр 1 из 13Следующая ⇒
Кафедра фармации Органические лекарственные препараты. Ароматические соединения. Краткий конспект лекций. Нижний Новгород УДК 615.014.479 Органические лекарственные препараты. Ароматические соединения. Краткий конспект лекций – Нижний Новгород: Изд-во Нижегородской государственной медицинской академии, 2004.
Краткий конспект лекций по фармацевтической химии составлен для иностранных студентов и студентов заочной формы обучения III курса. Рассмотрены свойства ароматических органических веществ, использующихся в качестве лекарственных препаратов, представлены методы получения, установления подлинности и количественного определения этих веществ.
Составлено в соответствии с примерной программой по фармацевтической химии и приказом МЗ РФ №93 от 31.03.97 «О поэтапном введении с 1997 г. итоговой государственной аттестации выпускников высших медицинских и фармацевтических ВУЗов».
Рекомендовано к изданию советом Нижегородской государственной медицинской академии.
Составители: Мельникова Н.Б., Кононова С.В., Пегова И.А., Попова Т.Н., Рыжова Е.С., Куликов М.В..
Рецензенты: профессор кафедры «Биотехнологии, физической и аналитической химии» Нижегородского государственного технического университета, д.х.н. Арбатский А.П. ; главный технолог ОАО «Нижфарм», к.ф.н. Чжен Ф.Х. © Н.Б. Мельникова, С.В. Кононова, И.А. Пегова, Т.Н. Попова, Е.С. Рыжова, М.В. Куликов, 2004.
Содержание
Ароматические соединения (арены). Общая характеристика. Арены – соединения с планарной циклической ароматической системой, в которых все атомы цикла участвуют в образовании единой сопряженной системы, включающей согласно правилу Хюккеля (4n+2) π -электронов. Классификация аренов проводится по функциональным группам, т.к. они позволяют анализировать препараты и обуславливают физиологическое действие. Связь строения с физиологической активностью. Бензол – вещество очень токсичное, он и подобные ему вещества вызывают возбуждение двигательных центров и нарушение функции кроветворения. Длительное воздействие паров бензола может привести к смерти. Однако путем введения функциональных групп в бензольное кольцо можно не только снизить токсичность, но и придать его производным лечебное действие.
Общие закономерности. 1. Влияние алкильных заместителей. С увеличением длины углеводородной цепи от 1 до 5 физиологическая активность растет, дальнейшее увеличение числа атомов углерода снижает активность этого соединения.
При введении в бензольное кольцо двух алкильных заместителей активность уменьшается, особенно если они расположены в орто- и пара-положениях. Например, о-ксилол приблизительно в 5 раз, а n-ксилол в 7 раз менее активны, чем толуол.
2. Влияние растворимости веществ на токсичность. Галогенпроизводные аренов не проявляют ни анестезирующих, ни наркотических свойств. Введение атома хлора в молекулу бензола усиливает его токсичность, вследствие повышения растворимости вещества. Введение нескольких галоидных атомов (Hal) снижает физиологическую активность и токсичность, вследствие уменьшения растворимости полученного производного. Пример: 1, 4-дихлорбензол и трихлорбензол относительно не токсичны, но оказывают некоторое раздражающее и антисептическое действие.
Введение Cl и Br в боковую цепь обуславливает появление слезоточивых свойств, как это имеет место, например, у бромистого бензила.
3. Введение в ароматическое кольцо гидроксила вызывает появление антисептических свойств. Так, например, фенолы обладают бактерицидными свойствами. 4. Введение альдегидной группы в бензольное кольцо усиливает активность соединения. 5. Введение карбоксильной группы резко снижает токсическое действие (бензойная кислота – консервант), соли кислот более предпочтительны, т.к. оказывают меньшее раздражающее действие. 6. Введение в ароматическое кольцо аминогруппы: - усиливает токсическое действие. Так, например, анилин вызывает первоначально возбуждение, а затем депрессию ЦНС и образование метгемоглобина в крови. - введение дополнительно карбоксильной группы или блокирование аминогруппы ацетилированием снижает токсичность аминопроизводных аренов:
 
Фенолы, хиноны и их производные как лекарственные препараты Фенолы – производные аренов, содержащих одну или несколько гидроксильных групп.
Гидроксибензолы – бесцветные кристаллические вещества, реже жидкости, перегоняются с водяным паром. Растворимость: низшие фенолы растворимы в воде, большинство растворимы в этаноле, эфире, хлороформе, жирных маслах.
Химические свойства. Фенольный гидроксил – гидроксил, связанный с ароматическим циклом. 1. Кислотно–основные свойства обусловлены наличием в фенольном гидроксиле подвижного атома водорода. Электронная пара гидроксила смещена в сторону ароматического цикла, поэтому кислотные свойства более сильные, чем у спиртов. Так pKa угольной кислоты = 6, 35, а pKa фенола = 9, 89. Фенолы растворяются в водных растворах щелочей с образованием фенолятов (феноксидов):
Однако кислотный характер фенолов выражен настолько незначительно, что даже такая слабая кислота как угольная, вытесняет фенолы из их солей:
Поэтому фенолы, растворяясь в щелочах, не могут растворяться в карбонатах, т.к. освобождающаяся при этом угольная кислота тотчас же разлагает фенолят:
Это свойство фенолов отличает их от карбоновых кислот. При повышении температуры реакция идет в прямом направлении. Феноляты щелочных металлов, как соли сильных оснований и слабых кислот, частично гидролизованы в водных растворах, поэтому растворы фенолятов обладают щелочной реакцией.
2. Реакция этерификации (аналогично спиртовому гидроксилу). Образование простых эфиров – реакция фенолятов и галоидных алкилов (или алкилсульфатов).
C6H5ONa+JCH3®C6H5OCH3+NaJ
3. Окислительно – восстановительные свойства. Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями, при этом образуются окрашенные соединения хиноидной структуры.
Примером реакции окисления является образование индофенолового красителя: образующийся хинон при взаимодействии с NH3 превращается в хинонимин, который взаимодействует с не прореагировавшим фенолом. В присутствии аммиака образуется индофенол, окрашенный в синий цвет.
хинонимин индофенол n-бензохинонимин
Разновидностью индофеноловой реакции является нитрозореакция Либермана, которая характерна для тех фенолов, у которых нет заместителей в орто- и пара-положениях. При действии нитрита натрия в кислой среде образуется n-нитрозофенол, изомеризующийся в монооксим n-бензохинона, который затем, реагируя с избытком фенола в кислой среде, дает индофенол.
Наблюдается окрашивание, изменяющееся при добавлении раствора щелочи: фенол – темно-зеленое, переходящее в вишнево-красное; тимол – сине-зеленое, переходящее в фиолетовое; резорцин – фиолетово-черное, переходящее в фиолетовое; гексэстрол (синэстрол) – красно-фиолетовое, переходящее в вишневое.
4. Реакция комплексообразования с ионами железа. В зависимости от количества фенольных гидроксилов, наличия в молекуле других функциональных групп, их взаимного расположения, pH среды, температуры, образуются комплексные соединения различного состава и окраски (исключение – тимол).
4.1.
4.2.
4.3.
Комплексы окрашены: фенол – синий цвет; резорцин – сине-фиолетовый цвет; кислота салициловая – сине-фиолетовый или красно-фиолетовый цвет; осалмид (оксафенамид) – красно-фиолетовый цвет; натрия пара-аминосалицилат – красно-фиолетовый цвет; хинозол – синевато-зеленый цвет. Реакция является фармакопейной для большинства фенольных соединений.
5. Реакции электрофильного замещения – SE атома водорода в ароматическом кольце (бромирование, конденсация с альдегидами, сочетание с солями диазония, нитрование, нитрозирование, йодирование и др.). Способность фенолов вступать в реакции электрофильного замещения объясняется взаимодействием неподеленной электронной пары атома кислорода с π -электронами бензольного кольца. Электронная плотность смещается в сторону ароматического кольца. Наибольший избыток электронной плотности наблюдается у атомов углерода в о- и n-положениях по отношению к фенольному гидроксилу (ориентанту I рода).
5.1. Реакция галогенирования (бромирование и йодирование). 5.1.1. При взаимодействии с бромной водой образуются белые или желтые осадки бромпроизводных.
При избытке брома происходит окисление:
Реакция бромирования фенолов зависит от природы и положения заместителей. Аналогично происходит йодирование, например:
5.1.2. При наличии заместителей в о- и n-положениях ароматического кольца в реакцию вступают незамещенные атомы водорода ароматического кольца.
5.1.3. Если в о- и n-положениях по отношению к фенольному гидроксилу находится карбоксильная группа, то при действии избытка брома происходит декарбоксилирование:
5.1.4. Если соединение содержит два фенольных гидроксила в м-положении, то при действии брома образуются трибромпроизводные (согласованная ориентация):
5.1.5. Если две гидроксильные группы расположены по отношению друг к другу в о- или n-положениях, то реакция бромирования не протекает (несогласованная ориентация)
5.2. Реакции конденсации 5.2.1. С альдегидами. Примером конденсации фенолов с альдегидами является реакция с реактивом Марки. При нагревании фенолов с раствором формальдегида в присутствии концентрированной H2SO4 образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя.
5.2.2. Реакция фенолов с хлороформом (CHCl3) с образованием ауриновых красителей. При нагревании фенолов с CHCl3 в щелочной среде образуются аурины – трифенилметановые красители:
Аурины окрашены: фенол – желтый цвет; тимол – желтый цвет, переходящий в фиолетовый; резорцин – красно-фиолетовый цвет.
5.2.3. С ангидридами кислот.
А. Реакция образования флуоресцеина (конденсация резорцина с фталевым ангидридом).
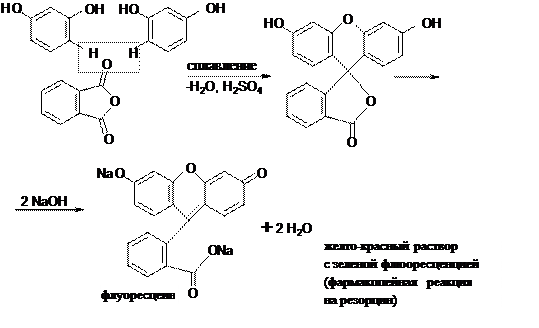 
Б. Реакция образования фенолфталеина (конденсация фенола с фталевым ангидридом).
При большом избытке щелочи образуется трехзамещенная натриевая соль. Конденсация тимола с фталевым ангидридом идет аналогично реакции образования фенолфталеина, образуется тимолфталеин, имеющий синее окрашивание в щелочной среде.
5.3. Реакция нитрования Фенолы вступают в реакцию с разбавленной азотной кислотой (HNO3) и образуют орто- и пара-нитропроизводные. Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциированной соли.
5.4. Реакция азосочетания фенолов с солью диазония в щелочной среде. При взаимодействии фенолов с солью диазония при pH 9-10 образуются азокрасители, окрашенные в желто-оранжевый или красный цвет. Реакция азосочетания протекает в орто- и пара-положениях по отношению к фенольному гидроксилу. В качестве диазореактива обычно применяют диазотированную сульфаниловую кислоту.
В случае фенола
Лекарственные вещества
1. Фенол, Phenolum purum, фенол чистый, гидроксибензол, Т.кип. =178‑ 182°С, Т.затв. не ниже 39.5°С (ГФ IX).
1) Из каменноугольной или древесной смолы: Этапы получения: 1.1. фракционная перегонка, выделяется фракция с Т.кип.= 170‑ 250°С; 1.2. обработка раствором NaOH, при этом образуются феноляты, переходящие в раствор; 1.3. обработка H2SO4; 1.4. перегонка, выделение фракции с Т.кип. =180‑ 200°С; 1.5. обработка хромовой смесью для удаления крезолов и фракционная перегонка с выделением фракции 178‑ 182°С. 2) Сульфированием бензола
Образовавшийся фенол очищают перегонкой, собирая фракцию с Т.кип. 178‑ 182°С. 3) Кумольным методом (Кружалов, Сергеев, Удрис)
2. Тимол, Thymolum, 1-гидрокси-2-изопропил-5-метилбензол (ГФ X);
Растворимость: плохо растворим в воде, легко – в спирте, эфирах, маслах, летуч с паром. Получение. 1) Из растительного сырья. Этапы получения: 1.1. омыление сложных эфиров тимола, содержащихся в масле чабреца, при нагревании со щелочью; 1.2. обработка концентрированной соляной кислотой – образуется тимол; 1.3. обезвоживание, фракционная перекристаллизация из спирта.
2) Из м-крезола, путем конденсации с изопропилхлоридом
3) из м-крезола, путем конденсации с диметилкетоном
Белый со слабым желтоватым оттенком кристаллический порошок с характерным запахом. Т.пл.=109‑ 112°С. Под влиянием света и воздуха постепенно окрашивается в розовый цвет. Растворимость: очень легко растворим в воде и 95% спирте, легко растворим в эфире, мало растворим в хлороформе, растворим в глицерине и жирном масле.
Получение. Резорцин получают сульфированием бензола. 1)
2)
3) Извлечение органическими растворителями и очистка перегонкой в вакууме. 4. Этамзилат, Etamsylatum, ФС, 2, 5-дигидроксибензолсульфонат диэтиламина.
Производное гидрохинона, легко растворимо в воде, практически не растворимо в эфире и хлороформе.
5. Синтетические заменители эстрогенных гормонов. 1) Синэстрол (ГФ X), Synoestrolum, мезо‑ 3, 4‑ ди‑ (n‑ гидроксифенил)гексан. мезо‑ 3, 4‑ ди(4’, 4”‑ гидроксифенил) гексан (ИЮПАК). Мезо-форма – это оптически неактивная форма, возникающая в результате компенсации вращения атома углерода в молекуле.
Практически не растворим в воде, легко – в этаноле. 2) Диэтилстильбэстрол, Diaethylstilboestrolum Транс-3, 4-ди(4’, 4”-гидроксифенил)-гексен-3 Цис-изомер малоактивен.
Практически не растворим в воде, мало растворим в хлороформе.
Получение. Синэстрол получают из анисового эфирного масла, содержащего анетол. а)
б)
D-изомер обладает в 500 раз, а L-изомер – в 5000 раз большей активностью, чем мезо-форма синэстрола.
Диэтилсильбэстрол получают дегидрированием мезо-формы синэстрола. При этом образуется транс-изомер.
Испытание на подлинность
1. Цветная реакция с хлоридом железа (III).
2. Реакции азосочетания с солями диазония характерны для всех производных фенолов. При этом образуются азокрасители, имеющие цвет от ярко-оранжевого до кроваво-красного. Эту реакцию ГФХ рекомендует для синэстрола.
3. Индофеноловые реакции, при которых образуются индофеноловые красители. При этом фенол дает зеленое окрашивание, а тимол и резорцин – синее.
4. Реакции конденсации:
а) с реактивом Марки резорцин образует красное окрашивание;
б) с хлороформом, в щелочной среде тимол и резорцин дают красно-фиолетовое окрашивание (фармакопейная реакция на тимол).
5. Реакция этерификации (ацилирования). Продукты реакции имеют четкую температуру плавления (ГФ рекомендует для синэстрола и диэтилстильбэстрола).
6. Реакция бромирования фенолов молекулярным бромом, приводящая к образованию осадков с четко выраженной характерной температурой плавления.
7. Реакция нитрования разбавленной азотной кислотой. Используется для идентификации – фенола, тимола, резорцина и синэстрола. 8. Специфические реакции.
9. Реакции феноксильного радикала.
Методы галогенирования. Основаны на реакции электрофильного замещения атомов водорода ароматического кольца на атомы галогена.
1.1. Броматометрический метод. 1.1.1. Прямое титрование раствором калия бромата фенола в присутствии калия бромида (индикатор метиловый оранжевый или метиловый красный). В точке эквивалентности избыточная капля калия бромата образует бром, который необратимо окисляет индикатор и происходит обесцвечивание раствора. Метод является фармакопейным для тимола.
КBrO3 + 5 КВr + 3 Н2SО4 → 3 Вr2 + 3 К2SО4+ 3 Н2О
fэкв(тимола)=1/4, т.к. fэкв (вещества)=1/n, где n - число атомов галогена, реагирующих с одной молекулой вещества.
1.1.2. Обратное титрование. К лекарственному веществу добавляют избыток титрованного раствора калия бромата и калия бромида, раствор подкисляют серной или хлороводородной кислотой. Образующийся бром вступает в реакцию электрофильного замещения с фенолом. Через 10-15 минут избыток брома определяют йодометрическим методом: добавляют калия йодид и выделившийся йод титруют раствором натрия тиосульфата (индикатор - крахмал). Иногда вместо крахмала применяют хлороформ - в этом случае титруют при сильном взбалтывании раствора до обесцвечивания хлороформного слоя. Обратное титрование используется, согласно ФС, для определения фенола, раствора гексэстрола (синэстрола) в масле для инъекций.
КBrO3 + 5 КВr + 3 Н2SО4 → 3 Вr2 + 3 К2SО4+ 3 Н2О
Избыток Br2 + 2 KI → I2 + 2 KBr I2 + 2Na2S2O3 → Na2S4O6 + 2NaI fэкв(резорцина, фенола, кислоты салициловой)=1/6, fэкв(гексэстрола)=1/8; 1.2. Йодометрический метод (прямое и обратное титрование). Так как реакция йодирования является обратимой, определение фенолов проводят в присутствии натрия гидрокарбоната или натрия ацетата для связывания выделяющегося йодоводорода.
NaHCO3 + HI → NaI + CO2 + H2O
При прямом титровании титруют до синего окрашивания, при обратном - избыток йода оттитровывают раствором натрия тиосульфата до обесцвечивания (в качестве индикатора используют крахмал). I2 + 2Na2S2O3 → Na2S4O6 + 2 NaI
Метод ацетилирования. Основан на свойстве фенолов образовывать при взаимодействии с уксусным ангидридом нерастворимые сложные эфиры.

CH3COOH + NaOH → CH3COONa + H2O fэкв(гексэстрола)=1/2; Метод является фармакопейным для гексэстрола (синэстрола). Условия определения и способы расчёта указаны в методах количественного определения спиртов. Применение. Фенол, тимол и резорцин обладают антисептическим действием. 1. Фенол – 0, 1-0, 5% для консервации сыворотки, лекарств, свечей; 3-5% для дезинфекции предметов обихода, инструментов, белья; иногда наружно при кожных заболеваниях, заболеваниях среднего уха. Форма выпуска – в порошке; в виде жидкости: смесь 100 частей расплавленного фенола и 10 частей воды, 5% раствор в глицерине; 2% мази. 2. Тимол – обладает меньшей токсичностью, чем фенол. Используется - внутрь как антигельминтное средство при глистных инвазиях, заболеваниях ЖКТ, поносах, метеоризмах. Наружно растворы тимола 0, 05-0, 1% применяются для дезинфекции полости рта, носоглотки. Форма выпуска – порошки (0, 05-0, 1 г). Не назначают детям до 6 лет. 3. Резорцин – используется наружно при кожных заболеваниях: дерматитах, экземах, грибковых заболеваниях в виде 2-5% водных и спиртовых растворов, 5-10-25% мазей; выпускается в порошке. 4. Этамзилат - повышает устойчивость капилляров, способствует остановке капиллярных кровотечений, оказывает гемостатическое действие. Форма выпуска – таблетки по 0, 25 г, парантерально 12, 5% раствор по 2 мл в ампулах. 5. Синэстрол и диэтилстильбэстрол – заместители эстрогенных гормонов; наибольшей активностью обладает мезо-изомер синэстрола и транс-изомер диэтилстильбэстрола. Применяется: диэтилстильбэстрол - при недостаточной функции яичников, раке молочной железы, синэстрол – при гипертрофии и раке предстательной железы у мужчин и раке молочной железы. Форма выпуска: синэстрол – таблетки по 1 мг и внутримышечно в виде масляных растворов 0, 1% и в виде 2-3% концентрации при злокачественных новообразованиях. ДЭС – 3% растворов в ампулах по 1 мл внутримышечно.
Получение викасола. А.В.Палладин, А.А.Шмук.
β -метилнафталин 2-метил-1, 4-нафтохинон
Подлинность викасола.
1. Гидролитическое разложение гидроксидом натрия.
1.1. Извлечение CHCl3 1.2. Очистка от примесей 1.3. Тпл 2-метил-1, 4-нафтохинона - 106-106, 5°С
2. Окисление концентрированной серной кислотой.
2.1. Фиксируется запах серы (lV) - SO2 2.2. Фильтровальную бумагу, смоченную KJO3 и крахмалом, помещают над пробиркой, наблюдается посинение. 5SO2 + 2 KJO3 → J2 + K2SO4 + 4SO3↑
3. Ионы Na+ доказывают по окрашиванию пламени в желтый цвет.
4. Витамины К1 и К2 и викасол образуют с этилатом натрия интенсивную, но неустойчивую фиолетовою окраску, переходящую в красную, а затем в устойчивую коричневую, которую можно использовать для колориметрического определения. УФ спектр викасола имеет λ max = 230 нм (Н2О) 231 нм (0, 1М HCl) 228 нм (этанол) Чистота викасола Определяют специфическую примесь NaНSO3 иодометрически (в среде H2SO4). Прибавляют избыток титрованного раствора йода, остаток которого оттитровывают Na2S2O3.
NaHSO3 + J2 + H2O NaHSO4 + 2HJ
J2 + 2 Na2S2O3 → 2NaJ + Na2S4O6
fэкв (NaHSO3) = ½, т.к. S+4 S+6
Допускается не более 2% примеси.
Применение. Витамины группы К принимают участие в образовании протромбина, синтез которого происходит в печени. Недостаточное содержание витамина К в организме приводит к кровоизлияниям. Витамины К обладают антигемморагическим, коагуляционным действием, способствуя свертываемости крови. Назначают при капиллярных и других кровотечениях, перед родами и операциями. Внутрь 0, 015-0, 03 г; внутримышечно по 1мл 1% раствора. Форма выпуска 1% раствор для инъекций, таблетки по 0, 015 г.
Хранение по списку Б.
Антивитамин К. Избыток в организме витамина К может привести к явлениям тромбоза или тромбофлебиту. Снять эти явления могут вещества, которые способны угнетать образование протромбина и, следовательно, способствовать понижению свертываемости крови. Такие вещества называют антикоагулянтами. К ним относится антивитамин К – дикумарин, неодикумарин и др.
Дикумарин Dicumarinum Ди-(4-оксикумаринил-3)метан
Парацетамол.
Paracetamolum, n-ацетаминофенол
Описание. Белый или белый с кремоватым или розовым оттенком кристаллический порошок, без запаха. Т.пл. = 167-172 °С. Мало растворим в воде, легко растворим в спирте, практически не растворим в эфире, легко растворим в растворах гидроксидов щелочных металлов. рКа =9, 92.
Получение
Фенол нитрозируется нитритом натрия в кислой среде, n-нитрозофенол восстанавливается сероводородом в аммиачной среде до n-аминофенола, который затем ацетилируется. Подлинность 1) МФ: УФ- спектр в метаноле: λ max= 249 нм УФ- спектр в 0, 001 М NaOH: λ max = 255нм λ max = 273 нм 2) Т.пл. = 168 – 172°С 3) Реакция по фенольному гидроксилу, образование комплексного соединения с FeCl3
4) Реакция на ароматическую аминогруппу, проводят кислотный гидролиз
Продукт гидролиза окисляют K2Cr2O7 до хинонимина. Непрореагировавший n-аминофенол при взаимодействии с хинонимином образует индофенол.
5) Гидролиз в среде серной кислоты, выделяется уксусная кислота, которую определяют по запаху
Чистота Устанавливают примесь свободного n-аминофенола нитритометрическим методом.
Получение. 1) Из толуола - окислением:
2) Из толуола – хлорированием с последующим омылением:
3) Из фталевой кислоты - декарбоксилированием:
2. Кислота салициловая, Acidum salicylicum.
Орто-оксибензойная кислота.
Белые мелкие игольчатые кристаллы или кристаллический порошок без запаха. Тпл=158-161°С. Мало растворим в воде, растворим в кипящей воде, легко растворим в этаноле и эфире, трудно растворим в хлороформе. Салициловая кислота широко распространена в природе, в листьях некоторых растений, в цветках ромашки. В виде метилового эфира салициловая кислота содержится во многих маслах, в том числе в масле гвоздики, туберозы, иве. В растениях метиловый эфир салициловой кислоты связан с сахарами в виде гликозидов, легко гидролизующихся под влиянием ферментов. Летуча с водяным паром, возгоняется. Относится к фенолокислотам.
Получение. Карбоксилированием фенола по реакции Кольбе – Шмидта.
салицилат натрия
Выпаренную досуха смесь фенола и NaOH нагревают в автоклаве (130°С) с СО2 под давлением 450 –500кПа (4, 5-5 атм). Продукт реакции растворяют в воде, подкисляют HCl и перекристаллизовывают. Побочный продукт реакции – оксидифенил.
3. Натрия бензоат. Natrii benzoas.
Белый кристаллический порошок без запаха или с очень слабым запахом, сладковато – соленого вкуса. Легко растворим в воде, трудно растворим в этаноле.
4. Натрия салицилат. Natrii salicylas.
Белый кристаллический порошок или мелкие чешуйки без запаха, сладковато-соленого вкуса. Легко растворим в воде, растворим в этаноле.
Получение Натрия бензоат и натрия салицилат получают, выпаривая досуха раствор соответствующей кислоты (бензойной или салициловой), нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:
Соли перекристаллизовывают из спирта.
Реакции подлинности. 1. ГФ Х. Бензойную кислоту и ее соли определяют по реакции комплексообразования с FeCl3.
1.1. Кислоту нейтрализуют щелочью (по индикатору рН≈ 7). В кислой среде осадок растворяется, в щелочной среде выпадает бурый осадок гидроксида железа (III).
1.2. С хлоридом железа (III) образуется комплексная соль: 6 C6H5COONa + 2FeCl3 + 10H2O → → (C6H5COO)3Fe· Fe(OH)3· 7H2O↓ + 3 C6H5COOH + 6 NaCl желтовато-розовый цвет
Популярное:
|
Последнее изменение этой страницы: 2016-04-11; Просмотров: 3177; Нарушение авторского права страницы