
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Ароматические соединения (арены).
Общая характеристика. Арены – соединения с планарной циклической ароматической системой, в которых все атомы цикла участвуют в образовании единой сопряженной системы, включающей согласно правилу Хюккеля (4n+2) π -электронов. Классификация аренов проводится по функциональным группам, т.к. они позволяют анализировать препараты и обуславливают физиологическое действие. Связь строения с физиологической активностью. Бензол – вещество очень токсичное, он и подобные ему вещества вызывают возбуждение двигательных центров и нарушение функции кроветворения. Длительное воздействие паров бензола может привести к смерти. Однако путем введения функциональных групп в бензольное кольцо можно не только снизить токсичность, но и придать его производным лечебное действие.
Общие закономерности. 1. Влияние алкильных заместителей. С увеличением длины углеводородной цепи от 1 до 5 физиологическая активность растет, дальнейшее увеличение числа атомов углерода снижает активность этого соединения.
При введении в бензольное кольцо двух алкильных заместителей активность уменьшается, особенно если они расположены в орто- и пара-положениях. Например, о-ксилол приблизительно в 5 раз, а n-ксилол в 7 раз менее активны, чем толуол.
2. Влияние растворимости веществ на токсичность. Галогенпроизводные аренов не проявляют ни анестезирующих, ни наркотических свойств. Введение атома хлора в молекулу бензола усиливает его токсичность, вследствие повышения растворимости вещества. Введение нескольких галоидных атомов (Hal) снижает физиологическую активность и токсичность, вследствие уменьшения растворимости полученного производного. Пример: 1, 4-дихлорбензол и трихлорбензол относительно не токсичны, но оказывают некоторое раздражающее и антисептическое действие.
Введение Cl и Br в боковую цепь обуславливает появление слезоточивых свойств, как это имеет место, например, у бромистого бензила.
3. Введение в ароматическое кольцо гидроксила вызывает появление антисептических свойств. Так, например, фенолы обладают бактерицидными свойствами. 4. Введение альдегидной группы в бензольное кольцо усиливает активность соединения. 5. Введение карбоксильной группы резко снижает токсическое действие (бензойная кислота – консервант), соли кислот более предпочтительны, т.к. оказывают меньшее раздражающее действие. 6. Введение в ароматическое кольцо аминогруппы: - усиливает токсическое действие. Так, например, анилин вызывает первоначально возбуждение, а затем депрессию ЦНС и образование метгемоглобина в крови. - введение дополнительно карбоксильной группы или блокирование аминогруппы ацетилированием снижает токсичность аминопроизводных аренов:
 
Фенолы, хиноны и их производные как лекарственные препараты Фенолы – производные аренов, содержащих одну или несколько гидроксильных групп.
Гидроксибензолы – бесцветные кристаллические вещества, реже жидкости, перегоняются с водяным паром. Растворимость: низшие фенолы растворимы в воде, большинство растворимы в этаноле, эфире, хлороформе, жирных маслах.
Химические свойства. Фенольный гидроксил – гидроксил, связанный с ароматическим циклом. 1. Кислотно–основные свойства обусловлены наличием в фенольном гидроксиле подвижного атома водорода. Электронная пара гидроксила смещена в сторону ароматического цикла, поэтому кислотные свойства более сильные, чем у спиртов. Так pKa угольной кислоты = 6, 35, а pKa фенола = 9, 89. Фенолы растворяются в водных растворах щелочей с образованием фенолятов (феноксидов):
Однако кислотный характер фенолов выражен настолько незначительно, что даже такая слабая кислота как угольная, вытесняет фенолы из их солей:
Поэтому фенолы, растворяясь в щелочах, не могут растворяться в карбонатах, т.к. освобождающаяся при этом угольная кислота тотчас же разлагает фенолят:
Это свойство фенолов отличает их от карбоновых кислот. При повышении температуры реакция идет в прямом направлении. Феноляты щелочных металлов, как соли сильных оснований и слабых кислот, частично гидролизованы в водных растворах, поэтому растворы фенолятов обладают щелочной реакцией.
2. Реакция этерификации (аналогично спиртовому гидроксилу). Образование простых эфиров – реакция фенолятов и галоидных алкилов (или алкилсульфатов).
C6H5ONa+JCH3®C6H5OCH3+NaJ
3. Окислительно – восстановительные свойства. Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями, при этом образуются окрашенные соединения хиноидной структуры.
Примером реакции окисления является образование индофенолового красителя: образующийся хинон при взаимодействии с NH3 превращается в хинонимин, который взаимодействует с не прореагировавшим фенолом. В присутствии аммиака образуется индофенол, окрашенный в синий цвет.
хинонимин индофенол n-бензохинонимин
Разновидностью индофеноловой реакции является нитрозореакция Либермана, которая характерна для тех фенолов, у которых нет заместителей в орто- и пара-положениях. При действии нитрита натрия в кислой среде образуется n-нитрозофенол, изомеризующийся в монооксим n-бензохинона, который затем, реагируя с избытком фенола в кислой среде, дает индофенол.
Наблюдается окрашивание, изменяющееся при добавлении раствора щелочи: фенол – темно-зеленое, переходящее в вишнево-красное; тимол – сине-зеленое, переходящее в фиолетовое; резорцин – фиолетово-черное, переходящее в фиолетовое; гексэстрол (синэстрол) – красно-фиолетовое, переходящее в вишневое.
4. Реакция комплексообразования с ионами железа. В зависимости от количества фенольных гидроксилов, наличия в молекуле других функциональных групп, их взаимного расположения, pH среды, температуры, образуются комплексные соединения различного состава и окраски (исключение – тимол).
4.1.
4.2.
4.3.
Комплексы окрашены: фенол – синий цвет; резорцин – сине-фиолетовый цвет; кислота салициловая – сине-фиолетовый или красно-фиолетовый цвет; осалмид (оксафенамид) – красно-фиолетовый цвет; натрия пара-аминосалицилат – красно-фиолетовый цвет; хинозол – синевато-зеленый цвет. Реакция является фармакопейной для большинства фенольных соединений.
5. Реакции электрофильного замещения – SE атома водорода в ароматическом кольце (бромирование, конденсация с альдегидами, сочетание с солями диазония, нитрование, нитрозирование, йодирование и др.). Способность фенолов вступать в реакции электрофильного замещения объясняется взаимодействием неподеленной электронной пары атома кислорода с π -электронами бензольного кольца. Электронная плотность смещается в сторону ароматического кольца. Наибольший избыток электронной плотности наблюдается у атомов углерода в о- и n-положениях по отношению к фенольному гидроксилу (ориентанту I рода).
5.1. Реакция галогенирования (бромирование и йодирование). 5.1.1. При взаимодействии с бромной водой образуются белые или желтые осадки бромпроизводных.
При избытке брома происходит окисление:
Реакция бромирования фенолов зависит от природы и положения заместителей. Аналогично происходит йодирование, например:
5.1.2. При наличии заместителей в о- и n-положениях ароматического кольца в реакцию вступают незамещенные атомы водорода ароматического кольца.
5.1.3. Если в о- и n-положениях по отношению к фенольному гидроксилу находится карбоксильная группа, то при действии избытка брома происходит декарбоксилирование:
5.1.4. Если соединение содержит два фенольных гидроксила в м-положении, то при действии брома образуются трибромпроизводные (согласованная ориентация):
5.1.5. Если две гидроксильные группы расположены по отношению друг к другу в о- или n-положениях, то реакция бромирования не протекает (несогласованная ориентация)
5.2. Реакции конденсации 5.2.1. С альдегидами. Примером конденсации фенолов с альдегидами является реакция с реактивом Марки. При нагревании фенолов с раствором формальдегида в присутствии концентрированной H2SO4 образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя.
5.2.2. Реакция фенолов с хлороформом (CHCl3) с образованием ауриновых красителей. При нагревании фенолов с CHCl3 в щелочной среде образуются аурины – трифенилметановые красители:
Аурины окрашены: фенол – желтый цвет; тимол – желтый цвет, переходящий в фиолетовый; резорцин – красно-фиолетовый цвет.
5.2.3. С ангидридами кислот.
А. Реакция образования флуоресцеина (конденсация резорцина с фталевым ангидридом).
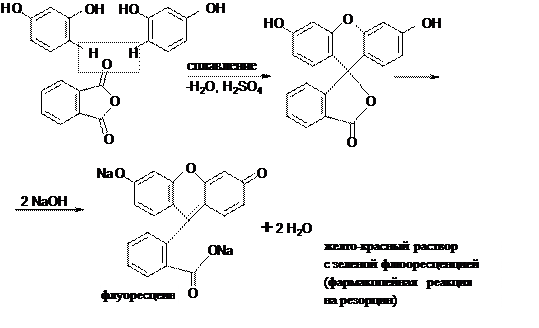 
Б. Реакция образования фенолфталеина (конденсация фенола с фталевым ангидридом).
При большом избытке щелочи образуется трехзамещенная натриевая соль. Конденсация тимола с фталевым ангидридом идет аналогично реакции образования фенолфталеина, образуется тимолфталеин, имеющий синее окрашивание в щелочной среде.
5.3. Реакция нитрования Фенолы вступают в реакцию с разбавленной азотной кислотой (HNO3) и образуют орто- и пара-нитропроизводные. Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциированной соли.
5.4. Реакция азосочетания фенолов с солью диазония в щелочной среде. При взаимодействии фенолов с солью диазония при pH 9-10 образуются азокрасители, окрашенные в желто-оранжевый или красный цвет. Реакция азосочетания протекает в орто- и пара-положениях по отношению к фенольному гидроксилу. В качестве диазореактива обычно применяют диазотированную сульфаниловую кислоту.
В случае фенола
Лекарственные вещества
1. Фенол, Phenolum purum, фенол чистый, гидроксибензол, Т.кип. =178‑ 182°С, Т.затв. не ниже 39.5°С (ГФ IX).
1) Из каменноугольной или древесной смолы: Этапы получения: 1.1. фракционная перегонка, выделяется фракция с Т.кип.= 170‑ 250°С; 1.2. обработка раствором NaOH, при этом образуются феноляты, переходящие в раствор; 1.3. обработка H2SO4; 1.4. перегонка, выделение фракции с Т.кип. =180‑ 200°С; 1.5. обработка хромовой смесью для удаления крезолов и фракционная перегонка с выделением фракции 178‑ 182°С. 2) Сульфированием бензола
Образовавшийся фенол очищают перегонкой, собирая фракцию с Т.кип. 178‑ 182°С. 3) Кумольным методом (Кружалов, Сергеев, Удрис)
2. Тимол, Thymolum, 1-гидрокси-2-изопропил-5-метилбензол (ГФ X);
Растворимость: плохо растворим в воде, легко – в спирте, эфирах, маслах, летуч с паром. Получение. 1) Из растительного сырья. Этапы получения: 1.1. омыление сложных эфиров тимола, содержащихся в масле чабреца, при нагревании со щелочью; 1.2. обработка концентрированной соляной кислотой – образуется тимол; 1.3. обезвоживание, фракционная перекристаллизация из спирта.
2) Из м-крезола, путем конденсации с изопропилхлоридом
3) из м-крезола, путем конденсации с диметилкетоном
Белый со слабым желтоватым оттенком кристаллический порошок с характерным запахом. Т.пл.=109‑ 112°С. Под влиянием света и воздуха постепенно окрашивается в розовый цвет. Растворимость: очень легко растворим в воде и 95% спирте, легко растворим в эфире, мало растворим в хлороформе, растворим в глицерине и жирном масле.
Получение. Резорцин получают сульфированием бензола. 1)
2)
3) Извлечение органическими растворителями и очистка перегонкой в вакууме. 4. Этамзилат, Etamsylatum, ФС, 2, 5-дигидроксибензолсульфонат диэтиламина.
Производное гидрохинона, легко растворимо в воде, практически не растворимо в эфире и хлороформе.
5. Синтетические заменители эстрогенных гормонов. 1) Синэстрол (ГФ X), Synoestrolum, мезо‑ 3, 4‑ ди‑ (n‑ гидроксифенил)гексан. мезо‑ 3, 4‑ ди(4’, 4”‑ гидроксифенил) гексан (ИЮПАК). Мезо-форма – это оптически неактивная форма, возникающая в результате компенсации вращения атома углерода в молекуле.
Практически не растворим в воде, легко – в этаноле. 2) Диэтилстильбэстрол, Diaethylstilboestrolum Транс-3, 4-ди(4’, 4”-гидроксифенил)-гексен-3 Цис-изомер малоактивен.
Практически не растворим в воде, мало растворим в хлороформе.
Получение. Синэстрол получают из анисового эфирного масла, содержащего анетол. а)
б)
D-изомер обладает в 500 раз, а L-изомер – в 5000 раз большей активностью, чем мезо-форма синэстрола.
Диэтилсильбэстрол получают дегидрированием мезо-формы синэстрола. При этом образуется транс-изомер.
Испытание на подлинность
1. Цветная реакция с хлоридом железа (III).
2. Реакции азосочетания с солями диазония характерны для всех производных фенолов. При этом образуются азокрасители, имеющие цвет от ярко-оранжевого до кроваво-красного. Эту реакцию ГФХ рекомендует для синэстрола.
3. Индофеноловые реакции, при которых образуются индофеноловые красители. При этом фенол дает зеленое окрашивание, а тимол и резорцин – синее.
4. Реакции конденсации:
а) с реактивом Марки резорцин образует красное окрашивание;
б) с хлороформом, в щелочной среде тимол и резорцин дают красно-фиолетовое окрашивание (фармакопейная реакция на тимол).
5. Реакция этерификации (ацилирования). Продукты реакции имеют четкую температуру плавления (ГФ рекомендует для синэстрола и диэтилстильбэстрола).
6. Реакция бромирования фенолов молекулярным бромом, приводящая к образованию осадков с четко выраженной характерной температурой плавления.
7. Реакция нитрования разбавленной азотной кислотой. Используется для идентификации – фенола, тимола, резорцина и синэстрола. 8. Специфические реакции.
9. Реакции феноксильного радикала.
Популярное:
|
Последнее изменение этой страницы: 2016-04-11; Просмотров: 2891; Нарушение авторского права страницы