
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
ОСНОВЫ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙСтр 1 из 17Следующая ⇒
ЛЕКЦИЯ № 1 ОСНОВЫ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о строении, номенклатуре органических соединений. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Основы строения органических соединений. 2. Номенклатура органических соединений.
СОДЕРЖАНИЕ ЛЕКЦИИ Основы строения органических соединений
Органическая химия – это химия соединений углерода. Особенности органических веществ: • Многообразие в природе: около 27 млн. (неорганических веществ – около 100 тысяч). • Образуются небольшим количеством атомов-неметаллов, которые получили названия органогены: С, Н, О, N (реже S, Р, галогены). Атомы в составе молекулы соединены между собой в определенном порядке, в соответствии с их валентностью. Атом углерода четырехвалентен. Порядок соединения атомов называется химическим строением молекулы и отображается с помощью структурных формул.
Основные связи – ковалентные: По полярности различают: • С–С – неполярные ковалентные связи; • С–Н – малополярные ковалентные связи; • С–О; С–N – полярные ковалентные связи.
По симметрии орбиталей различают: • σ -Cвязь – ковалентная связь, образованная при перекрывании атомных орбиталей вдоль оси, соединяющей ядра атомов:
• π -Связь – ковалентная связь, возникающая при боковом перекрывании негибридных p-орбиталей. При этом локализованные p-атомные орбитали делокализуются, образуя π -орбитали:
По порядку связи различают: •
• Двойные (1 σ -связь и 1 π -связь), например, в молекуле этилена (0, 134 нм):
• Ионная связь встречается в органических соединениях редко:
В основном органические вещества имеют молекулярное строение. Для них характерна низкая температура плавления, соединения не прочны. Атом углерода образует связи в состоянии: sp3-гибридизации (характерна для алканов): С–С; sp2-гибридизации (характерна для алкенов): С=С; sp-гибридизации (характерна для алкинов): С≡ С. Гибридизация – процесс выравнивания энергии и образование равноценных по форме и энергии орбиталей. Электронное строение атома углерода: 1s22s22p2
• sp3-Гибридизация. В этом случае выравниваются энергии одной 2s и трёх 2p-орбиталей, при этом образуются 4 одинаковые sp3-орбитали: • sp2-Гибридизация. Энергии одной 2s и двух 2p-орбиталей выравниваются, при этом образуются 3 одинаковые sp2-орбитали и остаётся одна негибридная p-орбиталь:
Гибридные орбитали отталкиваются друг от друга, образуя треугольную (тригональную) структуру, поэтому атом углерода в состоянии sp2-гибридизации называется тригональным:
Негибридная p-орбиталь располагается перпендикулярно плоскости, проходящей через три гибридные орбитали:
Три sp2-гибридные орбитали участвуют в образовании трёх σ -связей: например в этилене:
Две негибридные орбитали перекрываются с образованием π -связи:
• sp-Гибридизация. В этом случае выравниваются энергии одной 2s и одной 2π -орбиталей, при этом образуются 2 одинаковые sp-орбитали и остаются негибридными две p-орбитали. Две sp-гибридные орбитали отталкиваются друг от друга, при этом максимумы электронной плотности располагаются на одной прямой: Две негибридные p-орбитали располагаются перпендикулярно друг другу в одной плоскости, которая перпендикулярна этой прямой x:
Классификация органических соединений I. По типу углеродного скелета II. По типу связи Заместительная номенклатура ИЮПАК · Выбор главной углеродной цепи (родоначальной структуры). · Нумерация цепи. · Составление названия. Характеристическая (функциональная) группа – атомы или группы атомов, определяющие химические свойства соединения и принадлежность его к определенному классу.
Номенклатура алканов · Выбирают самую длинную углеводородную цепь. · Нумеруют цепь, начиная с того конца цепи, к которому ближе находится разветвление. · Называют алкан, перечисляя алкильные заместители, указывая их количество и положение.
Метилпропан
Номенклатура алкенов этан → этен (этилен) пропан → пропен (пропилен) • Главная цепь обязательно должна включать в себя двойную связь, поэтому она может быть и не самой длинной. • Нумерацию начинают с того конца цепи, который ближе к двойной связи. • Цифра, обозначающая положение двойной связи, ставится после суффикса -ен.
4-метилгексен-1 Номенклатура алкинов этан → этин; пропан → пропин и т.д. • Нумерацию углеродных атомов начинают с того конца, к которому ближе тройная связь.
6-метилгептин-2 · Главная цепь обязательно должна включать в себя тройную связь.
4-пропилоктин-2 Номенклатура спиртов метан → метанол; этан → этанол и т.д. · Нумерацию углеродных атомов начинают с того конца, к которому ближе гидроксильная группа. · К родоначальной структуре добавляют суффикс –ол. · Цифрой указывают положение гидроксильной группы.
СН3–СН=СН–СН–СН2ОН ½ СН3 2-метилпентен-3-ол-1
Номенклатура альдегидов
· Нумерацию углеродных атомов начинают с того конца, к которому ближе альдегидная группа. · К родоначальной структуре добавляют суффикс –аль.
метан метаналь этан этаналь ЛЕКЦИЯ № 2 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о критериях ароматичности, мезомерном и индуктивном электронных эффектах заместителей. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Индуктивный эффект. Сопряжённые системы с открытой и замкнутой цепью сопряжения. Ароматичность, критерии ароматичности. Энергия сопряжения. 2. Мезомерный эффект в открытых и замкнутых системах. 3. Зависимость реакционной способности органических соединений от индуктивных и мезомерных электронных эффектов заместителей. Ориентанты первого и второго рода.
СОДЕРЖАНИЕ ЛЕКЦИИ ЛЕКЦИЯ №3 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний об изомерии органических соединений. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Изомерия, Структурная изомерия, её виды. Пространственная изомерия, её виды, Оптическая изомерия (энантиомерия). 2. s- и p-Диастереомерия. Примеры их проявления у биологически активных соединений.
СОДЕРЖАНИЕ ЛЕКЦИИ Энантиомерия Энантиомерия возможна у любых органических соединений, имеющих ассиметрический атом углерода, соединённый с четырьмя различными атомами или группами атомов. Например, молекула 2-гидроксипропановой кислоты. Молекулы веществ, содержащих ассиметрический атом углерода, называют хиральными. Наши руки не содержат элементов симметрии и относятся друг к другу как предмет к своему зеркальному изображению. Они не могут быть совмещены в пространстве. Хиральные молекулы также не содержат элементов симметрии и относятся друг к другу как предмет к своему зеркальному изображению и не могут быть полностью совмещены в пространстве.
Энантиомеры – стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. Для обозначения внешней конфигурации энантиомеров вводится понятие о D- и L-формах. Для энантиомеров с одним хиральным центром: D-форма – энантиомер, в котором заместитель (–ОН группа и др.), соединённые с хиральным центром, записывается справа по отношению к углеродной цепи, а L-форма – слева. В 2-гидроксипропановой кислоте –ОН группа – D, L-определяющий гидроксил.
D (-) мясомолочная кислота L (+) молочная кислота
Энантиомеры обладают оптической активностью. Они способны вращать плоскость поляризации света. Оптическая активность энантиомеров исследуется с помощью прибора – поляриметра, в котором луч света, пройдя через специальную призму Николя, колеблется только в одной плоскости, становится плоскополяризованным. Энантиомеры способны отклонять его либо влево, либо вправо. У энантиомеров угол вращения плоскости поляризации света одинаковый, но направление вращения противоположное. Один энантиомер – левовращающий, знак (-), а другой правовращающий, знак (+). У молочной кислоты D (-); a=-2, 6° и L (+); a=+2, 6° при 22°С в 2, 5 % водном растворе. Знак вращения плоскости поляризации света не связан с принадлежностью к D- или L-ряду. Он определяется экспериментально. Таким образом, энантиомеры, обладая одинаковыми физическими и химическими свойствами, отличаются по оптическим свойствам. Они являются оптическими антиподами. Смесь равных количеств энантиомеров называется рацематом. Он не обладает оптической активностью. Организм избирательно относится к энантиомерам. Утомление мышц при длительной работе обусловлено накоплением в них L (+) молочной кислоты.
S- и p-Диастереомерия. Примеры их проявления у биологически активных соединений Многие биологически важные соединения содержат в молекуле более одного центра хиральности. Количество стереоизомеров для них определяют по формуле: z=2n, z – количество стереоизомеров, n – число хиральных центров. Например, 2, 3, 4 – тригидроксибутаналь. Количество стереоизомеров Z =2n. Первая пара энантиомеров 1) D-эритроза и 2) L-эритроза и вторая пара энантиомеров 3) D-треоза и 4) L-треоза. Энантиомеры каждой пары сходны между собой по физическим и химическим свойствам, но отличаются по оптическим свойствам, являются оптическими антиподами. 1 и 3; 1 и 4; 2 и 3; 2 и 4-ая пары стереоизомеров не являются энантиомерами, у них проявляется другой вид стереоизомерии – диастереоизомерия. Диастереоизомеры – это стереоизомеры, не являющиеся энантиомерами, т.е. «зеркальными» изомерами. У перечисленных выше пар стереоизомеров проявляется s-диастереометрия, т. к. заместители связаны с центром хиральности s-связями. Если заместители находятся по одну сторону углеродной цепи, то такой стереоизомер называют эритро-формой, если по разные стороны, то трео-формой. У s-диастереомеров конфигурация одного хирального центра одинаковая, а другого противоположная.
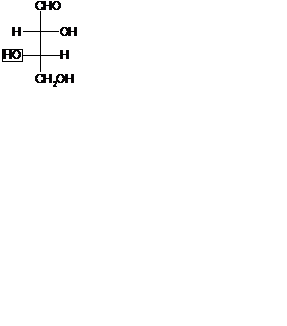 
s-Диастереомеры отличаются по физическим и химическим свойствам и не являются зеркальным изображением один другого. Понятие энантиомерии и s-диастереомерии взаимоисключающие. Если стереоизомеров не являются энантиомерами, то они будут s-диастереомерами. ЛЕКЦИЯ №4 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о протолитической теории кислот и оснований и влиянии на кислотность и основность различных факторов. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Кислотно-основные свойства органических соединений. 2. Факторы, влияющие на кислотные свойства органических соединений.
СОДЕРЖАНИЕ ЛЕКЦИИ ЛЕКЦИЯ №5 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о классификации, номенклатуре, изомерии спиртов и фенолов, их реакционной способности, роли в организме и применении в медицинской практике. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Гидроксисоединения. Спирты, их классификация, номенклатура, изомерия, применение. 2. Фенолы, их классификация, номенклатура, изомерия, применение. 3. Реакционная способность спиртов и фенолов. Реакции окисления, нуклеофильного и электрофильного замещения, качественная реакция на многоатомные спирты.
СОДЕРЖАНИЕ ЛЕКЦИИ Одноатомные спирты (R-OH) а) Этанол СН2–СН2–ОН. Используется в медицинской практике как обеззараживающее средство и для приготовления спиртовых растворов лекарственных веществ, например, настойка иода и др. б) Бензиловый спирт С6Н5–СН2–ОН. Используется для получения лекарственных препаратов, применяемых для лечения кожных, инфекционных и других заболеваний. Химические свойства спиртов 1. Окисление спиртов. Спирты подвергаются окислению in vitro под действием окислителей, например, К2Сr2O7, in vivo под действием ферментов, которые носят название дегидрогеназы. При этом происходит дегидрирование спирта. Субстрат (спирт) теряет два атома водорода. Это эквивалентно потере двух электронов 2е и двух протонов водорода 2Н+. а) Окисление первичных спиртов до альдегидов:
б) Окисление вторичных спиртов до кетонов: Пропанол-2 + НАД+ ® Пропанон + НАДН + Н+
Таким образом, при окислении первичных спиртов образуются альдегиды, а вторичных – кетоны.
2. Реакция нуклеофильного замещения (SN):
-C-Х + Y: → -С-Y + X: субстрат реаг. нуклеофил
В ходе реации нуклеофильного замещения атакующий реагент (нуклеофил) отдаёт субстрату свою пару электронов, за счёт которой образуется связь между атомом углерода субстрата и нуклеофилом, а уходящая группа (нуклеофуг) отщепляется со своей парой электронов. Рассмотрим реакцию нуклеофильного замещения на примере получения хлорэтана из этанола:
СН3 – СН2 – ОН + НCl → СН3 - СН2 – Сl + Н2О
Поскольку –ОН группа в молекуле субстрата (этанол) является плохо уходящей группой, то прямое нуклеофильное ззамещение осуществить не удается. Поэтому производят преобразование плохо уходящей группы в хорощо уходящую группу. Для этого в субстрате уходящую группу –ОН (нуклеофуг) переводят в ониевую в присутсвии ионов Н+, чтобы она отщепилась в виде нейтральной молекулы. При этом образуется промежуточный ион этилоксония, от которого отщепляется молекуда воды – хорошо уходящая группа. Реагент (нуклеофил) присоединяется за счёт своей пары электронов к атому водорода субстрата. Так получается хлорэтан, применяемый в медицине для ингаляционного наркоза. Реакции дегидратации а) Внутримолекулярная дегидратация с образованием алкенов:
б) Межмолекулярная дегидратация с образованием простых эфиров:
этанол диэтиловый эфир 4. Реакция этерификации с образованием сложных эфиров:
уксусная кислота этанол этилацетат ЛЕКЦИЯ № 6 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о классификации, номенклатуре, изомерии карбонильных соединений, их реакционной способности, ролью в организме и применении в медицинской практике. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Карбонильные соединения, их классификация, электронное строение карбонильной группы. 2. Химические свойства.
СОДЕРЖАНИЕ ЛЕКЦИИ Химические свойства
1. Окисление альдегидов до карбоновых кислот:
ЛЕКЦИЯ № 7 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о классификации, номенклатуре, изомерии карбоновых кислот и их производных, их реакционной способности, роли в организме и применении в медицинской практике. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Классификация карбоновых кислот. 2. Химические свойства кабоновых кислот. 3. Медико-биологическое значение карбоновых кислот. Фарм. препараты на основе салициловой кислоты.
СОДЕРЖАНИЕ ЛЕКЦИИ Реакции окисления Рассмотрим на примере гидроксикислот. Окисление гидроксикислот протекает аналогично окислению вторичных спиртов с участием ферментов-дегидрогеназ.
1) Окисление молочной кислоты до пировиноградной кислоты:
2) Окисление яблочной кислоты до щавелевоуксусной кислоты:
3) Окисление β -гидроксимасляной кислоты до ацетоуксусной кислоты:
[β -гидроксимасляная кислота = ацетоуксусная кислота + НАДН + Н+]
Салицилат натрия
Применяется внутрь как жаропонижающее и противовоспалительное средство.
Фенилсалицилат (салол)
Салол в медицине применяется внутрь как антисептик при заболеваниях кишечника (колитах) и мочевыводящих путей (циститах). Салол примечателен тем, что в кислой среде желудка он не гидролизуется и распадается только в кишечнике, поэтому применяется для изготовления оболочек лекарственных препаратов.
Метилсалицилат
В медицинской практике применяется наружно при артритах и радикулитах в качестве обезболивающего и противовоспалительного средства.
ЛЕКЦИЯ № 8 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о классификации, номенклатуре, изомерии биологически важных азотсодержащих гетероциклических соединений и их реакционной способности, роли в организме и применении в медицинской практике. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Классификация гетероциклических соединений. 2. Пятичленные гетероциклы с одним етероатомом. 3. Пятичленные гетероциклы с двумя гетероатомами. 4. Шестичленные гетероциклы с одним и двумя гетероатомами. 5. Конденсированные гетероциклы.
СОДЕРЖАНИЕ ЛЕКЦИИ ЛЕКЦИЯ № 9 УГЛЕВОДЫ. МОНОСАХАРИДЫ ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о классификации, номенклатуре, изомерии моносахаридов, их реакционной способности, роли в организме и применении в медицинской практике. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Биологическая роль углеводов. 2. Классификация углеводов. 3. Моносахариды, представители альдоз, кетоз. 4. Циклические формы моносахаридов. 5. Химические свойства моносахаридов. 6. Производные моносахаридов. Аминосахара. Сахарные кислоты.
СОДЕРЖАНИЕ ЛЕКЦИИ
К углеводам относятся гетерофункциональные соединения полигидроксикарбонильного ряда и их производные. Углеводы входят в состав клеток и тканей всех растительных и животных организмов и соответственно составляют 80% и 2% от массы сухого остатка. Классификация углеводов По способности к гидролизу углеводы делятся на 2 класса: · простые – не подвергаются гидролизу; · сложные - гидролизуются с образованием простых углеводов. Простые делятся на: · моносахариды; · производные моносахаридов. Сложные на: · олигосахариды; · полисахариды. Полисахариды, в свою очередь, подразделяются на: · гомополисахариды; · гетерополисахариды.
Олигосахариды содержат от 2 до 10 остатков моносахаридов, а полисахариды – несколько десятков тысяч. И те, и другие являются продуктами поликонденсации моносахаридов.
Моносахариды Относятся к полигидроксикарбонильным соединениям. Классификация: I. По виду функциональной группы: 1) альдозы – полигидроксиальдегиды; 2) кетозы – полигедроксикетоны. II. По числу атомов углерода в цепи: 1. триозы; 2. тетрозы; 3. пентозы; 4. гексозы. С учетом 2-х признаков классификации к биологически важным относятся следующие классы.
Альдогексозы 1) Глюкоза (виноградный сахар). Энантиомером D-ряда углеводов соответствует энантиомер L-ряда с противоположной конфигурацией всех центров хиральности.
Глюкоза содержится практически во всех растительных организмах. В свободном состоянии регулирует осмотическое давление крови. При повышении концентрации глюкозы возникает явление гипергликемии. Если изомеры углеводов различаются конфигурацией только одного центра хиральности, то они называются эпимерами.
2)Галактоза. Является эпимером глюкозы в четвертом углеродном звене. Альдопентозы
1)D-рибоза. 2)D-ксилоза – эпимер рибозы в третьем углеродном звене. 3) Производным рибозы является дезоксисахар – 2-дезокси-D-рибоза (дезоксирибоза). Альдопентозы являются структурными компонентами нуклеиновых кислот. Рибоза входит в состав РНК, дезоксирибоза – ДНК. Кетогексозы
D-фруктоза – содержится во фруктах, мёде, входит в состав сахарозы, в организме легко изомеризуется в глюкозу.
ЛЕКЦИЯ № 9 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о классификации полисахаридов, их строении, роли в организме и применении в медицинской практике. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ 1. Классификация олигосахаридов. 2. Восстанавливающие дисахариды. Мальтоза, лактоза, целлобиоза. 3. Невосстанавливающие дисахариды. Сахароза. 4. Химические свойства дисахаридов. 5. Классификация полисахаридов. 6. Гомополисахариды. Крахмал, строение и биологическая роль. 7. Гликоген, строение и биологическая роль. 8. Клетчатка, строение и биологическая роль. 9. Гетерополисахариды, гиалуроновая кислота. 10. Гликопротеины.
СОДЕРЖАНИЕ ЛЕКЦИИ Олигосахариды (от греч. oligoV – несколько) – углеводы, гидролизующиеся с образованием нескольких молекул моносахаридов (2-10). Структура дисахаридов
По химической природе – это О-гликозиды: два остатка моносахаридов связаны друг с другом гликозидной связью. По строению и химическим связям дисахариды делят на 2 типа: I. восстанавливающие (мальтоза, лактоза, целлобиоза), II. невосстанавливающие (сахароза).
Реакции окисления Восстанавливающие дисахариды окисляются мягкими окислителями до соответствующих карбоновых кислот. Окислители: Реактив Фелинга, реактив Толленса, бром и другие окислители, окисляющие альдегиды. Пример: окисление мальтозы:
Классификация полисахаридов Гликопротеины Гликопротеины – это смешанные углеводсодержащие биополимеры, в которых белковая молекула связана с углеводами – олигосахаридами. К гликопротеинам относятся ферменты, гормоны, иммуноглобулины и муцины. К этим сложным веществам принадлежат вещества, определяющие групповую специфичность крови. В их основе лежит полипептидная цепь, к которой присоединяются олигосахаридные цепочки (до 55 штук). Углеводный компонент и белковая часть связываются О-гликозидной связью с участием гидроксильных групп аминокислот серина и треонина. В состав углеводного компонента входят N-ацетил-D-галактозамин, N-ацетил-D-глюкозамин, D-галактоза, которые располагаются в определённой последовательности от не- восстановливающегося конца олигосахаридной цепочки (в количестве от 3 до 5). Эта последовательность называется детерминантой, именно она определяет специфичность группы крови. Детерминантным моносахаридом группы крови А служит N-ацетил-D-галактозамин, а группы β -D-галактоза. С изменением детерминанты меняется группа крови. Муцины – это гликопротеины, в небелковой части которой содержится глюкозамин, сиаловая кислота, N-ацетил-D-галактозамин и остаток серной кислоты. Слово «муцины» образовано от греческого mucos-слизь. Муцины входят в состав слюны, яичного белка, секретов кишечника и бронхов. Их присутствие в растворе обеспечивает высокую вязкость среды. ЛЕКЦИЯ № 10 ЦЕЛИ ЛЕКЦИИ Обучающая – Формирование знаний о классификации, номенклатуре, изомерии аминокислот, их реакционной способности, роли в организме и применении в медицинской практике. Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление. Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия». ПЛАН ЛЕКЦИИ Строение a-аминокислот. СОДЕРЖАНИЕ ЛЕКЦИИ СТРОЕНИЕ a-АМИНОКИСЛОТ a-Аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один из атомов водорода замещен аминогруппой (-NH2). Общее число a-аминокислот достигает 300, но из них выделяют группу 20-ти наиболее важных a-аминокислот, встречающихся в составе белков животного и растительного происхождения. Общая формула a-аминокислот имеет вид:
Все a-аминокислоты за исключением глицина (H2N-CH2-COOH) являются оптически активными веществами, так как содержат асимметричный атом углерода и существуют в виде энантиомеров. В белках животного происхождения содержатся a, L-аминокислоты; a, D-аминокислоты встречаются в белках микроорганизмов. Боковая цепь a-аминокислот имеет специфический состав и строение для каждой a-аминокислоты. Кроме углеводородных радикалов боковая цепь может содержать функциональные группы (-ОН, -SH, -COOH, -NH2) и остатки гетероциклов. Состав боковой цепи определяет основные физико-химические свойства a-аминокислот и белков. 1. Гидрофильность, то есть способность полярных группировок боковой цепи к образованию водородных связей с молекулой воды объясняется содержанием в вариабельном фрагменте гидрофильных групп (-ОН, -SH, -COOH, -NH2, [-N=], [-N(H)-]). Способность a-аминокислот растворяться в воде является главным фактором, с которым связана всасываемость аминокислот и их транспорт в организме. К гидрофобным группам боковой цепи, снижающим растворимость, относятся углеводородные радикалы и бензольное кольцо. 2. Ионогенность боковой цепи, т.е. способность ионизироваться в водородном растворе, объясняется наличием в ее составе ионогенных групп, диссоциирующих по кислотному механизму: -COOH ® -COO—+H+ (боковая цепь приобретает отрицательный заряд); -SH ® -S-+H+ (боковая цепь приобретает отрицательный заряд); Ar-OH ® Ar-O—+H+ (боковая цепь приобретает отрицательный заряд) По основному механизму: -NH2+H+ ® -NH3+ В водном растворе молекулы a-аминокислот и белков, как правило, заряжены, и наличие заряда в сочетании с устойчивой гидратной оболочкой является важным фактором, определяющим устойчивость раствора белка.
Глицин (ГЛИ) A-Аминоуксусная кислота Аланин (АЛА) A-Аминопропионовая кислота Валин (ВАЛ) Лейцин (ЛЕЙ) Изолейцин ( ИЛЕ ) Аспарагиновая кислота (АСП) A-Аминоянтарная кислота Глутаминовая кислота (ГЛУ) A-Аминоглутаровая кислота Боковые радикалы a-аминокислот этой подгруппы гидрофильные, ионогенные, несут отрицательный заряд (-OOC ¾ CH2 ¾ ). В состав белков входят амиды данных кислот. Аспарагин (АСН) Глутамин (ГЛН) III. Диаминомонокарбоновые α -аминокислоты (основные) Лизин (ЛИЗ) Аргинин (АРГ) IV. Оксиаминокислоты Серин (СЕР) Треонин (ТРЕ) Цистеин (ЦИС) Цистин (ЦИС-ЦИС) a, a¢ -Диамино-b, b¢ -димеркаптопропионовая кислота Метионин (МЕТ) Фенилаланин (Фен) A-Амино-b-фенилпропионовая Кислота Тирозин (ТИР) Гистидин (ГИС) α -Амино-b-имидазолилпропионовая кислота Триптофан (ТРИ) Иминокислоты
Пролин (ПРО) Популярное:
|
Последнее изменение этой страницы: 2016-05-28; Просмотров: 1617; Нарушение авторского права страницы